
【题目】2019年是门捷列夫发现元素周期律150周年。某学习小组同学为探究同周期或同主族元素性质的递变规律,分别设计了如下实验:
Ⅰ.将少量等质量的钾、钠、镁、铝分别投入到足量的同浓度的盐酸中,试预测实验结果:
【1】上述金属中与盐酸反应最剧烈_____。
A.钾B.钠C.镁D.铝
【2】上述金属中与盐酸反应生成相同条件下的气体最多_____。
A.钾B.钠C.镁D.铝
Ⅱ.利用图装置来验证同主族元素非金属性的变化规律:
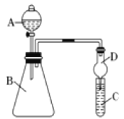
现要证明非金属性:Cl>I。在A中加浓盐酸,C中加淀粉碘化钾混合溶液,B中加某试剂。
常温下,通过合理操作,观察到C中溶液变蓝的现象,即可证明。
请结合装置回答下列问题:
【3】B中可加入_____
A.MnO2固体B.KMnO4固体C.浓H2SO4D.大理石
【4】仪器A的名称是_____
A.普通漏斗B.长颈漏斗C.分液漏斗D.容量瓶
【5】从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用 吸收尾气。
A.澄清石灰水B.KBr溶液C.浓H2SO4D.NaOH溶液
【答案】
【1】A
【2】D
【3】B
【4】C
【5】D
【解析】
Ⅰ.(1)根据金属活动性顺序表可以判断钾、钠、镁、铝的活泼性,金属活泼性越强,与盐酸反应越剧烈;
(2)根据电子守恒比较生成氢气在相同条件下的体积大小;
Ⅱ.要证明非金属性:Cl>I,可根据氯气能够将碘离子氧化成碘单质,则B装置为氯气的制备装置;氯气有毒,多余的氯气用氢氧化钠溶液吸收,据此分析解答。
【1】金属活泼性顺序为:钾>钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钾,反应速率最慢的是铝;故合理选项是A;
【2】生成1 mol氢气需要得到2 mol电子,钾、钠都是+1价的金属,1mol 钾质量是39g,失去1 mol电子,1 mol钠质量是23 g,失去1 mol电子,Mg是+2价的金属,1 mol镁质量是24g,失去2 mol电子,Al是+3价的金属,而1 mol铝质量是27 g,失去3 mol电子,所以等质量的四种金属失去电子的物质的量最多的是Al,则生成相同条件下氢气最多的是金属铝,故合理选项是D;
【3】根据以上分析,发生装置为氯气的制备装置,浓盐酸和高锰酸钾在常温下反应生成氯气,则B中可加入KMnO4固体,故合理选项是B;
【4】根据仪器的结构可知仪器A的名称是分液漏斗,故合理选项是C;
【5】氯气是有毒气体,在排放前要进行尾气处理,可根据氯气能够与碱反应的性质,多余的氯气用氢氧化钠溶液进行吸收,所以从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用NaOH溶液吸收尾气,故合理选项是D。
本题考查了探究金属单质的金属性强弱、非金属单质的非金属性强弱比较方法,掌握判断金属性、非金属性强弱的方法是解题的关键。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】下列装置有关说法错误的是( )
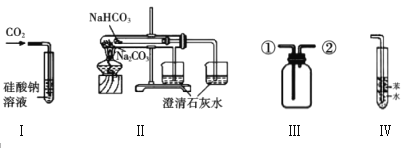
A.装置Ⅰ:可以用来验证硅酸和碳酸的酸性强弱
B.装置Ⅱ:可以用来比较![]() 和
和![]() 的热稳定性
的热稳定性
C.装置Ⅲ:从①口进气收集满二氧化碳,再从②口进气,可收集![]() 气体
气体
D.装置Ⅳ:可用于吸收![]() 气体,并防止倒吸
气体,并防止倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固定容积为1L的密闭容器中,1molA(g)与1molB(g)在催化剂作用下加热到500℃发生反应:A(g)+B(g)![]() C(g)+2D(s) ΔH>0,下列有关说法正确的是
C(g)+2D(s) ΔH>0,下列有关说法正确的是
A. 升高温度,![]() 增大,
增大,![]() 逆减小
逆减小
B. 平衡后再加入1molB,上述反应的ΔH增大
C. 通入稀有气体,压强增大,平衡向正反应方向移动
D. 若B的平衡转化率为50%,则该反应的平衡常数等于2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把图2中的物质补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。

对该氧化还原反应的离子方程式,下列说法不正确的是
A. IO4-作氧化剂,具有氧化性 B. 氧化性: MnO4-> IO4-
C. 氧化剂和还原剂的物质的量之比为5 :2 D. 若有2molMn2+参加反应,则转移10mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.中国传统文化是人类文明的瑰宝,古代文献中记载了大量古代化学的研究成果。回答下面问题:
(1)我国最原始的陶瓷约出现在距今12000年前,制作瓷器所用的原料是高岭士,其晶体化学式是Al4[Si4O10](OH)8,用氧化物表示其组成为______________。
(2)《本草纲目》中记载:“(火药)乃焰消( KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者。”反应原理为:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,该反应的氧化剂是____ ,反应转移4mol电子时,被S氧化的C有____mol。
K2S+N2↑+3CO2↑,该反应的氧化剂是____ ,反应转移4mol电子时,被S氧化的C有____mol。
(3)我国古代中药学著作《新修本草》记载的药物有844种,其中有关“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑁璃…烧之赤色…。”我国早期科技丛书《物理小适-金石类》 记载有加热青矾时的景象:“青矾厂气熏人,衣服当之易烂,载木不盛。”青矾就是绿矾( FeSO4·7H2O)。根据以上信息,写出“青矾”受热分解的化学方程式_________________。
Ⅱ.“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。
(4)请写出金属钒与浓硝酸反应的离子方程式:_______________________________。
(5)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:_____________、 _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】获取安全的饮用水成为人们关注的重要问题。回答下列问题:

(1)漂白粉常用于自来水消毒。工业上用氯气和石灰乳制取漂白粉的化学方程式为_________。实验室用MnO2与浓盐酸反应制备Cl2 的反应装置如图所示,制备实验开始时先检查装置气密性,接下来的操作依次是_____________________(填下列序号)。
①往烧瓶中加入浓盐酸 ②加热 ③往烧瓶中加入MnO2粉末
(2)聚铁[Fe2(OH)n(SO4)3-0.5n]m是一种高效无机水处理剂,制备原理是调节Fe2(SO4)3溶液的pH,促进其水解制取。用铁的氧化物制取聚铁的流程如下:
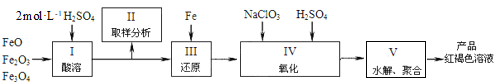
①实验室配制2mol·L-1的稀硫酸250mL需98%的浓硫酸(ρ=1.84g·mL-1)_______mL,配制过程中应使用的玻璃仪器有玻璃棒、烧杯、量筒、________________________。
②步骤Ⅳ中发生反应的离子方程式为_______________。
③步骤Ⅴ中需将溶液加热到70~80 ℃的目的是________________。Ⅴ中溶液的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的方法为_____________;若溶液的pH偏小,将导致聚铁中铁的质量分数__________(填“偏高”、“偏低”或“无影响”)。
(3)硬水易导致产生锅炉水垢[主要成分为CaCO3、Mg(OH)2、CaSO4],不仅会降低燃料的利用率,还会影响锅炉的使用寿命,造成安全隐患,因此要定期清除。清除时首先用饱和Na2CO3溶液浸泡水垢,发生CaSO4(s)+CO32-(aq) ![]() CaCO3(s)+SO42-(aq),该反应的平衡常数K =_______。然后再用醋酸溶解、水洗涤。已知:Ksp(CaSO4)=7.5×10-5、Ksp(CaCO3)=3.0×10-9。
CaCO3(s)+SO42-(aq),该反应的平衡常数K =_______。然后再用醋酸溶解、水洗涤。已知:Ksp(CaSO4)=7.5×10-5、Ksp(CaCO3)=3.0×10-9。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生话密切相关。下列说法错误的是
A. 生活中用到的陶瓷,如日用器皿、建筑饰材、卫生活具等主要是传统硅酸盐陶瓷
B. 铝制餐具不宜用来蒸煮或长时间存放酸性和碱性食物,但可长时间存放咸的食物
C. 洗发时使用的护发素主要是调节头发的![]() ,使之达到适宜的酸碱度
,使之达到适宜的酸碱度
D. 煤的干馏、海带提碘、石油裂解、芒硝风化等都涉及化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业上使用的印刷电路板,是在敷有铜膜的塑料板上以涂层保护所要的线路,然后用三氯化铁浓溶液作用掉(腐蚀)未受保护的铜膜后形成的。某工程师为了从使用过的腐蚀废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤:
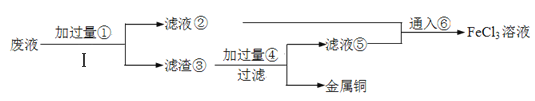
(1)步骤Ⅰ的操作名称:________;所需玻璃仪器:_________、_________、__________。
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:______________________。
(3)检验废腐蚀液中是否含有Fe3+所需试剂名称:___________、实验现象:__________。
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:________________,此转化的化学方程式为:______________________________。
(5)写出③中所含物质:_________⑥发生反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对溶液中的反应,如图像中m表示生成沉淀的物质的量,n表示参加反应的某一种反应物的物质的量,则下列叙述中错误的是:
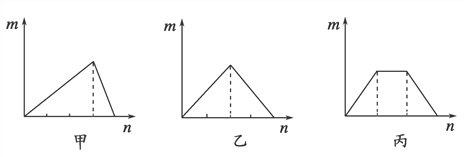
A.符合甲图像的两种反应物可以是AlCl3和NaOH
B.符合乙图像的两种反应物可以是Ca(OH)2和CO2
C.符合丙图像的反应可以是在Ca(OH)2和KOH的混合溶液中通入CO2
D.符合丙图像的反应可以是在NH4Al(SO4)2溶液中加入NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com