
�ϳɰ��������ѧ�����ϵ�һ���ش�ͻ�ƣ��䷴Ӧԭ��Ϊ
N2(g)��3H2(g)2NH3(g)����H����92.4 kJ��mol��1��
һ�ֹ�ҵ�ϳɰ��ļ�ʽ����ͼ���£�

(1)��Ȼ���е�H2S���ʳ��ð�ˮ���գ�����ΪNH4HS��һ����������NH4HS��Һ��ͨ��������õ�������ʹ����Һ������д��������Ӧ�Ļ�ѧ����ʽ��________________________________________________________________________��
(2)���������������ԭ�����£�
��CH4(g)��H2O(g)CO(g)��3H2(g)
��H����206.4 kJ��mol��1
��CO(g)��H2O(g)CO2(g)��H2(g)
��H����41.2 kJ��mol��1
���ڷ�Ӧ�٣�һ���������ƽ����ϵ��H2�İٷֺ��������ܼӿ췴Ӧ���ʵĴ�ʩ��____________��
a�������¶ȡ�b������ˮ����Ũ�ȡ�c�����������d������ѹǿ
���÷�Ӧ�ڣ���CO��һ��ת���������H2�IJ�������1 mol CO��H2�Ļ������(CO���������Ϊ20%)��H2O��Ӧ���õ�1.18 mol CO��CO2��H2�Ļ�����壬��CO��ת����Ϊ____________��
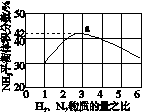
(3)ͼ(a)��ʾ500 �桢60.0 MPa�����£�ԭ����Ͷ�ϱ���ƽ��ʱNH3��������Ĺ�ϵ������ͼ��a�����ݼ���N2��ƽ�����������____________��
(4)�����¶ȶԺϳɰ���Ӧ��Ӱ�죬��ͼ(b)����ϵ�У�����һ�������µ��ܱ������ڣ���ͨ��ԭ������ʼ�����¶Ȳ������ߣ�NH3���ʵ����仯������ʾ��ͼ��
 ��
��
(a)������������������(b)
(5)��������ͼ�У�ʹ�ϳɰ��ų��������õ�������õ���Ҫ������(�����)________����������������ߺϳɰ�ԭ����ת���ʵķ�����________________________________________________________________________
________________________________________________________________________��
(1)2NH4HS��O2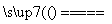 2NH3��H2O��2S��
2NH3��H2O��2S��
(2)a��90%
(3)14.5%
(4)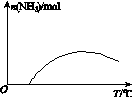
(5)������ԭ������ѹ������Һ����δ��Ӧ��N2��H2ѭ��ʹ��
[����] (1)�������֪Ϊ�����е�O2��������������Ϊ���ʣ����ݵ����غ㽫����ʽ��ƽ���ɡ�(2)��Ӧ��Ϊ�������ʵ�����������ȷ�Ӧ������ѹǿʹƽ�����ƣ�����Ӧ���ʼ�С��d�����������ܸı䷴Ӧ�ȣ������ܸı�H2�İٷֺ�����c��������ˮ����Ũ�����ʹ��Ӧ���������Լ�ƽ�����ƣ�������H2�İٷֺ���ȴ��С��b���������¶ȷ�Ӧ����������ƽ�������ƶ���H2�İٷֺ�������a�ԡ�CO��H2�Ļ��������ˮ�����ķ�Ӧ�У���Ӧ��ϵ�е���������ʵ������䣬��1 molCO��H2�Ļ������μӷ�Ӧ����1.18 mol�������˵����0.18 mol ˮ�����μӷ�Ӧ������ݷ���ʽ�ڿ�֪�μӷ�Ӧ��COҲΪ0.18 mol������ת����Ϊ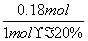 ��100%��90%��
��100%��90%��
(3)��ͼ�п�����N2��H2���ʵ�����Ϊ1��3ʱ��NH3��ƽ������������Ϊ42%����ƽ��ʱת����N2�����ʵ���Ϊx mol��������ʽ��
����������N2��3H22NH3
��ʼ(mol): 1 3 0
ת��(mol): x 3x 2x
ƽ��(mol): 1��x 3�� 3x 2x
 ��100%��42%����x��0.59
��100%��42%����x��0.59
��ƽ��ʱN2���������Ϊ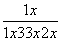 ��100%��14.5%��(4)��ͼʱҪע�ʼʱNH3���ʵ����������࣬����Ϊ��Ӧ�������(��Ӧδ��ƽ��)���ﵽһ���̶Ⱥ�Ӧ�ﵽƽ�����ʱ�¶ȼ������ߣ�ƽ�������ƶ���NH3�����ʵ�����С��(5)�Ƚ���������ʹ��Ҫ���ȵ����ʵõ����ȣ�������ʹ��Ҫ��ȴ�����ʵõ���ȴ���ܳ�������������ϳɰ���ӦΪ�������ʵ�����С�ķ�Ӧ����ѹ���ڷ�Ӧ������У����⣬ѭ�����ÿɷ�������ԭ�ϣ����ԭ�������ʡ�
��100%��14.5%��(4)��ͼʱҪע�ʼʱNH3���ʵ����������࣬����Ϊ��Ӧ�������(��Ӧδ��ƽ��)���ﵽһ���̶Ⱥ�Ӧ�ﵽƽ�����ʱ�¶ȼ������ߣ�ƽ�������ƶ���NH3�����ʵ�����С��(5)�Ƚ���������ʹ��Ҫ���ȵ����ʵõ����ȣ�������ʹ��Ҫ��ȴ�����ʵõ���ȴ���ܳ�������������ϳɰ���ӦΪ�������ʵ�����С�ķ�Ӧ����ѹ���ڷ�Ӧ������У����⣬ѭ�����ÿɷ�������ԭ�ϣ����ԭ�������ʡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�±���������֮��ͨ��һ����Ӧ������ʵ������ͼ��ʾת����ϵ����
| ѡ�� | X | Y | Z | ��ͷ������ ���ֵķ�Ӧ���� |
| A | Na2O2 | NaOH | NaCl | �� ������ˮ |
| B | AlCl3 | NaAlO2 | Al(OH)3 | �� ͨ��CO2 |
| C | NO | NO2 | HNO3 | �� ����ͭ�� |
| D | Cl2 | NaClO | HClO | �� ��Ũ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
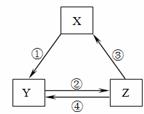
��ͼ��ʵ�������Ʊ��������֤�������ʵ�װ��ͼ

(1)д����A��ȡ�����Ļ�ѧ����ʽ_________________________________________��
(2)������ͼװ���Ʊ���������������֤�������ԣ�Cl2>Fe3+
��װ��B�е���Һ��������___________________________________��
װ��D�мӵ�����Լ���(�����)___________��
��ѡ�Լ���a��ŨH2SO4 b��FeCl2��Һ c��KSCN��FeCl2�Ļ����Һ d����ˮ�Ȼ���
(3)����ͼ��ʾԲ����ƿ�ڼ���̼��a�м���Ũ���ᣬ��ʼʵ�飬���Ȳ��������建��ͨ������װ��ͬʱ�������ʵ�飺
ʵ��1��֤��SO2���������Ժ�Ư����
ʵ��2��֤��̼Ԫ�صķǽ����Աȹ�Ԫ�ص�ǿ
֤��SO2�������Ժ�Ư���ԣ�B��Ϊ����Na2S��Һ��C�м�Ʒ����Һ��D��Ӧ����������__________(����Һ����)��E�м���___________��Һ(�ѧʽ)��
(4)֤��̼Ԫ�صķǽ����Աȹ�Ԫ�ص�ǿ������Ϊ______________________��
ʵ��2���Ͻ�֮��Ӧ��θĽ�________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�±��ж����ӷ���ʽ��д��������ȷ����
| ѡ�� | ��ѧ��Ӧ�����ӷ���ʽ | ���� |
| A | �����ۼ��뺬����������Һ�У� 2Na+��2OH��+2Al+H2O=2Na++AlO2��+3H2�� | ��ȷ |
| B | Na2O2��H2O��Ӧ�� Na2O2��H2O===2Na+��2OH����O2�� | ������Ԫ�ز��غ� |
| C | ̼����������ᷴӦ�� HCO3��+H+= H2O+CO2�� | ��ȷ |
| D | ��FeCl3��Һ�еμ�������ˮ�� Fe3+��3OH��=== Fe(OH)3�� | ��ȷ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����NaHCO3��Na2CO3��xH2O�Ļ���Ϊ�˲ⶨxֵ��ijͬѧ������ͼ��ʾ��װ�ý���ʵ��(CaCl2����ʯ�Ҿ���������ʾ��CaCl2��һ�����Ը����)��
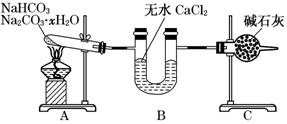
(1)Aװ�õ�������___________________________________________________��
(2)Bװ�õ�������___________________________________________________��
(3)Cװ�õ�������__________________________________________________��
(4)����װ��A���Թ���װ��NaHCO3��Na2CO3��xH2O�Ļ����3.7 g���þƾ��Ƽ��ȵ���Ӧ��ȫ����ʱB������1.89 g��C������0.22 g����x��ֵΪ______��
(5)��װ�û����Ǻ����ƣ�����ʹ�ⶨ���ƫС��Ӧ��θĽ�______ ��Ϊʲô��______________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ���¶��£�10 mL 0.40 mol/L H2O2��Һ�������ֽ⡣��ͬʱ�̲������O2�����(������Ϊ��״��)���±���
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
������������ȷ����(��Һ����仯���Բ���)(����)
A��0��6 min��ƽ����Ӧ���ʣ�
v(H2O2)��3.3��10��2mol��L��1��min��1
B��0��6 min��ƽ����Ӧ���ʣ�
v(H2O2)<3.3��10��2mol��L��1��min��1
C����Ӧ��6 minʱ��c(H2O2)��0.30 mol/L
D����Ӧ��6 minʱ��H2O2�ֽ���50%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ݻ�Ϊ1.00 L�������У�ͨ��һ������N2O4��������ӦN2O4(g) 2NO2(g)�����¶����ߣ�����������ɫ���
2NO2(g)�����¶����ߣ�����������ɫ���
�ش��������⣺
(1)��Ӧ�Ħ�H________0(����ڡ���С�ڡ�)��100 ��ʱ����ϵ�и�����Ũ����ʱ��仯��ͼ��ʾ����0��60 sʱ�Σ���Ӧ����v(N2O4)Ϊ________mol��L��1��s��1����Ӧ��ƽ�ⳣ��K1Ϊ________��
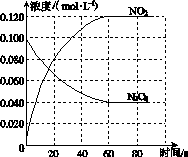
(2)100 ��ʱ��ƽ��ı䷴Ӧ�¶�ΪT��c(N2O4)��0.002 0 mol��L��1��s��1��ƽ�����ʽ��ͣ���10 s�ִﵽƽ�⡣
��T________100 ��(����ڡ���С�ڡ�)���ж�������____________________________��
����ʽ�����¶�Tʱ��Ӧ��ƽ�ⳣ��K2��_______________________________________
________________________________________________________________________��
(3)�¶�Tʱ��Ӧ��ƽ�����Ӧ�������ݻ�����һ�룬ƽ����________(�����Ӧ�����淴Ӧ��)�����ƶ����ж�������__________________________________________________
________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
H2O2��һ����ɫ������ԭ�Լ����ڻ�ѧ�о���Ӧ�ù㷺��
(1)ijС������ͬŨ��Fe3���Ĵ��£�̽��H2O2Ũ�ȶ�H2O2�ֽⷴӦ���ʵ�Ӱ�졣��ѡ�Լ���������30%H2O2��Һ��0.1 mol��L��1Fe2(SO4)3��Һ������ˮ����ƿ��˫������ˮ�ۡ����ܡ��������ܡ���Ͳ�����������ˮԡ�ۡ�ע������
��д����ʵ��H2O2�ֽⷴӦ����ʽ����������ת�Ƶķ������Ŀ��______________________________��
�����ʵ�鷽�����ڲ�ͬH2O2Ũ���£��ⶨ________(Ҫ������õ�������ֱ�����ַ�Ӧ���ʴ�С)��
�����ʵ��װ�ã����ͼ�е�װ��ʾ��ͼ��
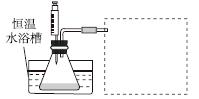
�ܲ����±���ʽ���ⶨʵ�������������ʵ�鷽��(�г���ѡ�Լ���������¼�Ĵ��������������ⶨ�����ݣ���������ĸ��ʾ)��
| ���������� ʵ����� ���� | V[0.1 mol��L��1 Fe2(SO4)3]/mL | ���� | |
| 1 | a | ���� | |
| 2 | a | ���� |
(2)����ͼ(a)��(b)�е���Ϣ����ͼ(c)װ��(��ͨ��A��Bƿ���ѳ���NO2����)����ʵ�顣�ɹ۲쵽Bƿ��������ɫ��Aƿ�е�__________(����dz��)����ԭ����____________________________��
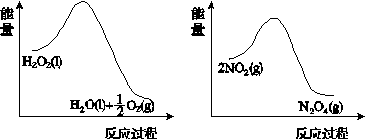
����������(a)������������������������(b)
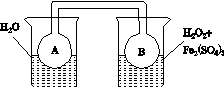
(c)
ͼ21
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
25�桢101kPa �£���2Na(s)��1/2O2(g)=Na2O(s) ��H1=��414KJ/mol
��2Na(s)��O2(g)=Na2O2(s) ��H2=��511KJ/mol
����˵����ȷ����
A.�ٺ͢ڲ�����������Ӹ����Ȳ����
B.�ٺ͢����ɵ����ʵ����IJ��ת�Ƶ�������ͬ
C.������Na������O2��Ӧ����Na2O�����¶���������Na2O�������ӿ�
D.25�桢101kPa �£�Na2O2��s��+2 Na��s��= 2Na2O��s�� ��H=��317kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com