
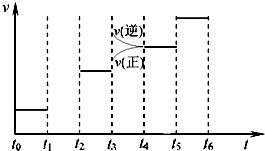
| 0.3mol |
| 2L |
| 0.9mol |
| 2L |
| 0.15mol/L |
| 0.45mol/L |
| 0.15mol/L |
| 2min |
| [NH3]2 |
| [N2]?[H2]3 |
| 0.12 |
| 0.1×0.33 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
A、在稀氨水中通入过量CO2:NH3?H2O+CO2=NH
| ||||
| B、向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | ||||
| C、向碳酸氢钙溶液中滴入过量澄清石灰水:Ca2++2HCO3-+2OH-→CaCO3↓+CO32-+2H2O | ||||
D、NH4HSO4溶液中加入足量Ba(OH)2溶液:H++SO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
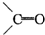 ),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3
),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3| O3 |
| Zn、H2O |
| A、0.25 | B、0.33 |
| C、0.40 | D、0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯、乙烯都既能发生加成反应,也能发生氧化反应 |
| B、塑料、橡胶和合成纤维都属于有机高分子化合物 |
| C、糖类、脂肪和蛋白质在一定条件下都能发生水解反应 |
| D、分子式为C12H22O11的糖有蔗糖和麦芽糖,它们属于同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
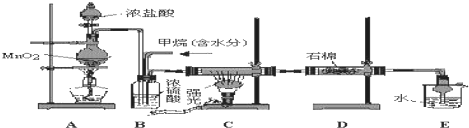
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子的最外层均有5个电子,最高价均为+5价 |
| B、非金属性比同周期的氧族元素和卤族元素弱 |
| C、原子半径比同周期的氧族元素、卤族元素小 |
| D、稳定性:NH3>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④⑤ | C、③⑤ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com