
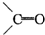
 ),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3
),这两步反应合在一起,称为“烯键的臭氧化还原”,例如:(CH3)2═CHCH3| O3 |
| Zn、H2O |
| A、0.25 | B、0.33 |
| C、0.40 | D、0.50 |
 、
、 、
、 ,
,| O3 |
| Zn、H2O |
| O3 |
| Zn、H2O |
| 1 |
| 2 |
| O3 |
| Zn、H2O |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.3mol |
| 0.3mol+0.3mol+0.6mol |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、2.24L CO2中含有的原子数为0.3NA |
| B、500mL 0.2mol/L的Fe2(SO4)3溶液中Fe3+总数为0.2NA |
| C、5.6g铁粉与硝酸完全反应失去的电子数一定为0.3NA |
| D、28g N2和CO的混合气体含有的原子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在盛有足量A的体积可变的密闭容器中通入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H>0,在一定温度、压强下达到平衡.平衡时C的物质的量与通入B的物质的量的变化关系如图所示.下列说法正确的是( )
在盛有足量A的体积可变的密闭容器中通入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H>0,在一定温度、压强下达到平衡.平衡时C的物质的量与通入B的物质的量的变化关系如图所示.下列说法正确的是( )| A、平衡时B的转化率为40% |
| B、若保持压强一定,当温度升高时,图中θ>45° |
| C、在容器中加入催化剂,则B的转化率增大 |
| D、若再通入B,则再次达平衡时C的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放Na2CO3的一端托盘下沉 |
| B、NaHCO3的一端托盘下沉 |
| C、仍保持平衡 |
| D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com