
【题目】在有机物中,若碳原子上连接的四个原子或原子团不相同,则这个碳原子称为手性碳原子,某有机物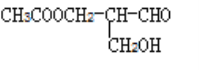 具有手性碳原子,发生下面的变化后仍一定具有手性碳原子的是( )
具有手性碳原子,发生下面的变化后仍一定具有手性碳原子的是( )
①与甲酸发生酯化反应 ②与NaOH溶液反应
③与银氨溶液反应 ④在催化剂存在下与氢气作用
A.①③B.②④C.①④D.②③
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法不正确的是( )
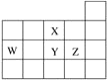
A.W、Y、X三种元素的原子半径依次减小
B.Z元素的简单气态氢化物的热稳定性比Y的高
C.Z的非金属性比Y的强,所以Z氢化物的沸点比Y的高
D.Y元素的单质能从NaZ溶液中置换出Z元素的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B.一种烃在足量的氧气中燃烧并通过浓硫酸,减少的总体积就是生成的水蒸气的体积
C.某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减小,则y>4;否则y<4
D.相同质量的烃,完全燃烧,消耗O2越多,烃中含H量越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42-)中回收氧化铁流程如下:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生的离子反应方程式:___________,指出使用空气的优点是:_________。
(2)已知Fe3+(aq)+3OH-(aq)===Fe(OH)3(s)ΔH=-Q1kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=_________。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=___________,c(Mg2+)=___________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时Fe(OH)3沉淀中可能混有的杂质是______ (填化学式,下同),用_______试剂可将其除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究物质的结构有助于对物质的性质进行研究。
(1)① 下列物质中含有羧基的是__________________(填字母)。
a.![]() b.
b.![]() c.
c.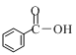
② 下列物质分子中所有原子处于同一平面的是__________________(填字母)。
a.苯 b.丙烯 c.甲醇
(2)乙烯使溴水或溴的四氯化碳溶液褪色的化学方程式_____________________,属于________反应,
(3)灼热的铜丝多次反复地插入乙醇中的现象是:___________________________,属于_______反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日,瑞典皇家科学院在斯德哥尔摩宣布,将2019年诺贝尔化学奖颁发给来自美国、英国、日本的三位科学家,表彰他们在锂离子电池方面的研究贡献。钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
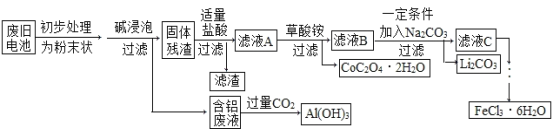
已知:①还原性:Cl->Co2+;
②Fe3+和C2O42-结合生成较稳定的[ Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。
回答下列问题:
(1)废旧电池初步处理为粉末状的目的是_______________。
(2)从含铝废液得到Al(OH)3的离子反应方程式为_______。
(3)写出LiCoO2和盐酸反应的化学方程式________________。滤液A中的溶质除HCl、LiCl外还有__________(填化学式)。
(4)滤渣的主要成分为____________________(填化学式)。
(5)从FeCl3溶液中得到FeCl3·6H2O固体的操作:先_________,再蒸发浓缩、冷却结晶。
(6)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2
②固体失重率=对应温度下样品失重的质量/样品的初始质量
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120-220 | CoC2O4·2H2O | 19.67% |
Ⅱ | 300~350 | _________________________ | 59.02% |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
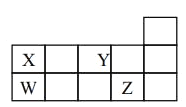
A.四种元素中原子半径最大为W,Y元素没有最高正价
B.四种元素最高价氧化物的水化物都是酸
C.XZ4、WY2中所含化学键类型相同,熔点都很高
D.W、WX都是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于资源综合利用和环境保护的化学方程式与工业生产实际不相符的是![]()
A.海水提溴时用![]() 吸收
吸收![]() 蒸气:
蒸气:![]()
B.将煤气化为可燃性气体:
C.用电解法冶炼金属镁:![]() 熔融
熔融![]()

D.燃煤时加入![]() 脱硫:
脱硫:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.已知冰的熔化热为6.0kJ·mol-1,冰中氢键键能为20kJ·mol-1。假设每摩尔水中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键
B.实验检测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916kJ·mol-1、-3747kJ·mol-1和-3265kJ·mol-1,可以证明在苯分子中不存在独立的碳碳双键
C.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,Ka=![]() 。若加入少量CH3COONa固体,则电离平衡CH3COOHCH3COO-+H+向左移动,α减小,Ka变小
。若加入少量CH3COONa固体,则电离平衡CH3COOHCH3COO-+H+向左移动,α减小,Ka变小
D.“水”电池是一种能利用淡水与海水之间含盐量差别进行发电的装置,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。则每生成1molNa2Mn5O10转移2mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com