
【题目】2019年10月9日,瑞典皇家科学院在斯德哥尔摩宣布,将2019年诺贝尔化学奖颁发给来自美国、英国、日本的三位科学家,表彰他们在锂离子电池方面的研究贡献。钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
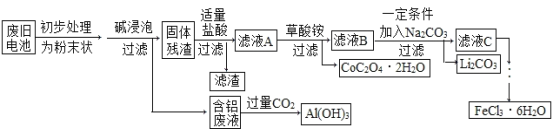
已知:①还原性:Cl->Co2+;
②Fe3+和C2O42-结合生成较稳定的[ Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。
回答下列问题:
(1)废旧电池初步处理为粉末状的目的是_______________。
(2)从含铝废液得到Al(OH)3的离子反应方程式为_______。
(3)写出LiCoO2和盐酸反应的化学方程式________________。滤液A中的溶质除HCl、LiCl外还有__________(填化学式)。
(4)滤渣的主要成分为____________________(填化学式)。
(5)从FeCl3溶液中得到FeCl3·6H2O固体的操作:先_________,再蒸发浓缩、冷却结晶。
(6)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2
②固体失重率=对应温度下样品失重的质量/样品的初始质量
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120-220 | CoC2O4·2H2O | 19.67% |
Ⅱ | 300~350 | _________________________ | 59.02% |
【答案】增大接触面积,加快反应速率,提高浸出率 AlO2-+CO2+2H2O==Al(OH)3↓+HCO3- 2LiCoO2+8HCl==2CoCl2+Cl2↑+4H2O+2LiCl FeCl3、CoCl2 C 加入适量盐酸(或通入适量氯化氢气体) ![]()
【解析】
(1)废旧电池初步处理为粉末状的目的是增大接触面,加快反应速率,提高浸出率,
答案为:增大接触面积,加快反应速率,提高浸出率;
(2)铝废液含有![]() ,通入过量的
,通入过量的![]() 得到碳酸氢根离子和氢氧化铝沉淀,离子反应方程式为:
得到碳酸氢根离子和氢氧化铝沉淀,离子反应方程式为:![]() ,
,
故答案为![]() ;
;
(3)因还原性![]() ,且滤液A中含有的是
,且滤液A中含有的是![]() ,所以
,所以![]() 和盐酸发生氧化还原反应生成氯气和
和盐酸发生氧化还原反应生成氯气和![]() ,方程式为:
,方程式为:![]() ,碱浸后的固体残渣不含铝,钴酸锂中的三价
,碱浸后的固体残渣不含铝,钴酸锂中的三价![]() 有强氧化性,把铁氧化为三价铁离子,本身被还原为
有强氧化性,把铁氧化为三价铁离子,本身被还原为![]() ,碳单质一般性质稳定,不与酸碱盐反应成为滤渣,故滤液A中还含有
,碳单质一般性质稳定,不与酸碱盐反应成为滤渣,故滤液A中还含有![]() 和
和![]() ,
,
故答案为:![]() ;
;![]() 、
、![]()
(4)碳单质一般性质稳定,不与酸碱盐反应成为滤渣,故滤渣的主要成分是![]() ,
,
故答案为:![]() ;
;
(5)氯化铁易水解得到氢氧化铁沉淀,所以要先加盐酸或通入氯化氢气体,抑制氯化铁的水解,
故答案为:加入适量盐酸(或通入适量氯化氢气体);
(6)由①可知,在120~220℃时,![]() 完全失去结晶水生成
完全失去结晶水生成![]() ,然后继续升高温度加热,则
,然后继续升高温度加热,则![]() 分解生成氧化物,其分解失去的质量为183g×59.02%=108g,剩余的质量为183g-108g=75g,设产物的化学式为
分解生成氧化物,其分解失去的质量为183g×59.02%=108g,剩余的质量为183g-108g=75g,设产物的化学式为![]() ,则
,则![]() ,解得
,解得![]() ,则化学式为
,则化学式为![]() ,故方程式为:
,故方程式为:![]() ,
,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】A、B、C、D 四种元素,原子序数依次增大,A 原子的最外层上有4个电子;B的阴离子和 C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)C离子的结构示意图为_____。D在周期表中位置_____。
(2)写出E的电子式:_____。
(3)A、D两元素形成的化合物属_____(填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A单质反应的化学方程式:_____。
(5)B 原子与氢原子形成的粒子中,与NH3具有相同电子数的阴离子为_____(填化学式),阳离子为_____(填化学式),阴离子的电子式为_____。
(6)A、D两元素形成的某化合物具有与CO2相似的结构,试用电子式表示其形成过程_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关卤代烃的叙述正确的是
A.CH2Cl2有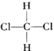 和
和![]() 两种结构
两种结构
B.氯乙烯只有一种结构,而1,2﹣二氯乙烯有两种结构(考虑立体异构)
C.检验溴乙烷中的溴元素可将其与过量NaOH水溶液共热充分反应后,再滴入AgNO3溶液,可观察到浅黄色沉淀生成
D.1﹣溴丙烷和2﹣溴丙烷分别与NaOH的乙醇溶液共热,产物相同,反应类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的物质的量保持不变的是( )
A.C2H4、C2H6OB.C2H6、C2H6OC.C3H6、C2H4D.C3H4、C2H6O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物中,若碳原子上连接的四个原子或原子团不相同,则这个碳原子称为手性碳原子,某有机物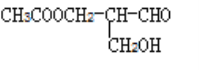 具有手性碳原子,发生下面的变化后仍一定具有手性碳原子的是( )
具有手性碳原子,发生下面的变化后仍一定具有手性碳原子的是( )
①与甲酸发生酯化反应 ②与NaOH溶液反应
③与银氨溶液反应 ④在催化剂存在下与氢气作用
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
①漂白粉、水玻璃、福尔马林都是混合物
②砹(At)是第ⅦA族,AgAt易溶于水
③用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
④Cs2CO3加热时不能分解为CO2和Cs2O
⑤纳米铁粉可以除被污染水体中的重金属离子
⑥根据反应SiO2+CaCO3![]() CaSiO3+CO2↑可推知硅酸酸性比碳酸强
CaSiO3+CO2↑可推知硅酸酸性比碳酸强
A.①③④⑤B.①④⑤C.③④⑤D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种物质中均含有同一种元素M,它们之间有如图所示的转化关系。A为一种金属单质,其产量直接关系国民经济命脉。反应①②③均为化合反应,反应④为置换反应。下列有关说法错误的是
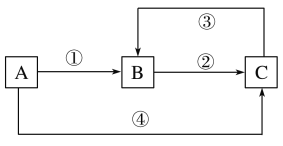
A. ①中所加试剂可能是氯气
B. ③中需要加具有氧化性的试剂
C. 元素M在②中发生的价态变化也能通过加碘化钾溶液实现
D. A与稀硝酸反应一定能实现元素M在①中发生的价态变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列装置属于原电池的是________。
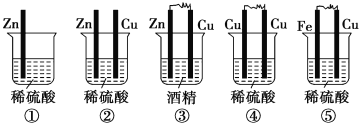
(2)在选出的原电池中,________是负极,发生________反应,________是正极,该极的现象是______________________________。
(3)此原电池反应的化学方程式为_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com