
【题目】(一)已知煤气化制合成气(CO 和H2)的主要反应有:
①C(s)+H2O(g)CO(g)+H2(g)△H1=131.3kJmol﹣1
②C(s)+2H2O(g)CO2(g)+2H2(g)△H2=90kJmol﹣1
(1)有利于提高上述反应①平衡转化率的条件是_____。
A.高温高压B.高温低压C.低温高压D.低温低压
(2)研究表明,将C(s)和H2O(g)置于密闭容器中发生反应①,升高温度,增大压强,氢气的含量也显著增大,理由是_____。
(3)由合成气制甲醇能发生反应:CO(g)+2H2(g)CH3OH(g)△H<0,在相同容积的 甲、乙、丙三个恒容密闭容器中分别投入amolCO和2amolH2,三个容器的反应温度分别为 T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时CO 的体积分数如图所示。
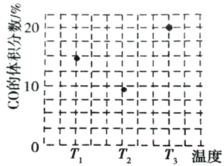
①三个容器中一定处于化学平衡状态的是_____(填“甲”“乙”或“丙”);该容器中CH3OH(g)的体积分数为_____。
②在图中分别画出反应CO(g)+2H2(g)CH3OH(g)△H<0在无催化剂、有催化剂两 种情况下“反应过程-能量”示意图_____。

(二)运用电解法,在酸性条件下可以将CO2转化为C3H8O,写出电解生成C3H8O的电极反应式_____。
【答案】B 温度对平衡正向移动的影响大于压强对平衡逆向移动的影响 丙 40% 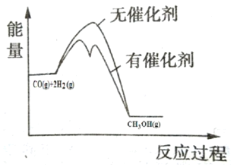 3CO2+18e﹣+18H+=C3H8O+5H2O
3CO2+18e﹣+18H+=C3H8O+5H2O
【解析】
(一)(1)反应①为吸热反应,随着反应进行,气体分子数增加,体系压强增大,升温、减压均有利于提高平衡转化率;
(2)升高温度,增大压强,氢气的含量也显著增大,说明平衡正向移动,升高温度对正向移动有利,增大压强对正向移动不利;
(3)①反应正反应为放热反应,根据图1中T1、T2、T3时CO百分含量,T2<T1<T3,结合化学平衡移动分析解答,根据平衡时CO的体积分数和化学反应方程式计算;
②催化剂降低反应的活化能,但不改变反应的焓变,据此作图;
(二)在酸性条件下可以将CO2转化为C3H8O,H+参与反应,反应为还原反应,H+转化为H2O,据此写出电极反应式。
(一)(1)反应①为吸热反应,随着反应进行,气体分子数增加,体系压强增大,升温、减压均有利于提高平衡转化率,所以控制的条件为高温低压,故答案为:B;
(2)升高温度,增大压强,氢气的含量 也显著增大,说明平衡正向移动,升高温度对正向移动有利,增大压强对正向移动不利,但平衡仍正向移动,说明温度对反应的影响大于压强对反应的影响,故答案为:温度对平衡正向移动的影响大于压强对平衡逆向移动的影响;
(3)①反应正反应为放热反应,根据图3中T1、T2、T3时CO百分含量由小到大依次为T2<T1<T3,T1中的状态转变成T2中的状态,CO百分含量减小,说明平衡正向移动,说明T1未达平衡状态,T2中的状态转变成T3中的平衡状态,CO百分含量增大,说明平衡逆向移动,说明T2可能达平衡状态,一定达到化学平衡状态的是丙,
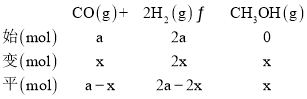
丙容器中平衡时CH3OH的体积分数为![]() ,可得x=
,可得x=![]() a,所以CH3OH(g) 的体积分数为
a,所以CH3OH(g) 的体积分数为![]() ;
;
②催化剂降低反应的活化能,但不改变反应的焓变,所以能量变化图为: ;
;
(二)在酸性条件下可以将 CO2转化为 C3H8O,H+参与反应,反应为还原反应,H+转化为H2O,所以电极反应为:3CO2+18e﹣+18H+=C3H8O+5H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】以炼锌烟尘(主要成分为 ZnO,含少量 CuO 和 FeO)为原料,制取氯化锌晶体(ZnCl2xH2O) 的工艺流程如下:
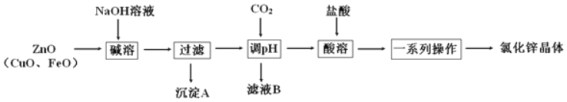 已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣。
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣。
(1)“调 pH”步骤中通入过量 CO2 时发生反应的离子方程式为_____。
(2)下列说法正确的是_____。
A.加入过量 NaOH 溶液的目的是提高锌元素的浸取率
B.沉淀 A 主要成分是 CuO、FeO
C.洗涤沉淀时,直接将洗涤液加入漏斗,并用玻璃棒轻轻搅拌
D.利用结晶法可以从氯化锌溶液中获得氯化锌晶体
(3)氯化锌晶体(ZnCl2xH2O)是白色晶体,可含 1、1.5、2.5、3、4个结晶水,易潮解,易溶于水,溶于乙醇、丙酮。由氯化锌晶体制备无水氯化锌的装置如图,其中滴液漏斗中盛放的是 SOCl2(SOCl2 熔点为﹣105℃、沸点 78.8℃、遇水剧烈水解生成两种酸性气体)。
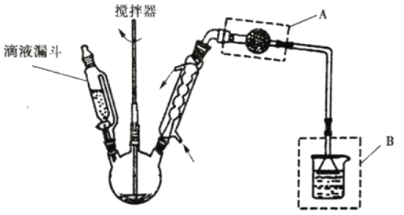
①下列物质中最适合洗涤氯化锌晶体的是_____。
A.冷水 B.浓盐酸 C.乙醇 D.氨水
②仪器 A 的名称为_____;装置 B 的作用是_____。
③以 ZnCl2H2O 为例,写出三颈烧瓶中发生反应的化学方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与下图对应的是( )
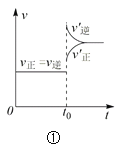
A.对于达到平衡状态的N2(g) + 3H2(g) 2NH3(g),图①表示在t0时刻充入了一定量的NH3,平衡逆向移动
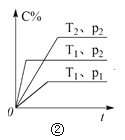
B.由图②可知,p2 > p1,T1 > T2满足反应:2A(g) + B(g) 2C(g) ΔH < 0
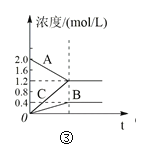
C.图③表示的反应方程式为2A = B + 3C
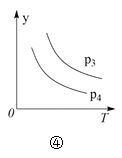
D.对于反应2X(g) + 3Y(g) 2Z(g) ΔH < 0,图④y轴可以表示Y的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是( )
A. 同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出
B. BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
C. BaSO4和BaCO3共存的悬浊液中, 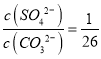
D. BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
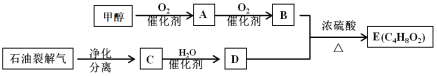
【题目】以甲醇和石油裂解气为原料可制得E,已知E由两种均具有芳香气味的有机物组成的混合物。相关物质转化关系如下:
请回答:
(1)写出C中官能团的化学式_______________。A的结构简式是___________________。
(2)C→D的化学方程式是_______________________________ 、_____________________________。
(3)含有相同官能团的有机物通常具有相似的化学性质,因此可以预测E具有与___________类化合物相似的化学性质。除去化合物B、D和E混合物中的B、D,可采用的方法是:__________________________________________________________________________。
(4)写出一种以![]() 为原料制备
为原料制备 ![]() 的合成路线。(各物质用结构简式表示即可,合成路线常用的表示方式为:__________________________________________________________
的合成路线。(各物质用结构简式表示即可,合成路线常用的表示方式为:__________________________________________________________![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在外加电流的阴极保护法中,须将被保护的钢铁设备与直流电源的负极相连
B. 反应H2S(g)+ZnO(s)===H2O(g)+ZnS(s)在一定条件下可自发进行,且ΔS<0,则ΔH>0
C. 常温常压,氢氧燃料电池工作消耗2.24 L O2时,转移电子的数目为0.4×6.02×1023
D. 常温下,Ksp[Cu(OH)2]=2.6×10-19,pH=10的含Cu2+的溶液中,c(Cu2+)≥2.6×10-11mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物E(C3H3Cl3)是一种播前除草剂的前体,其合成路线如图。已知D在反应⑤中所生成的E,其结构只有一种可能,E分子中有3种不同类型的氯原子(不考虑空间异构)。试回答下列问题:
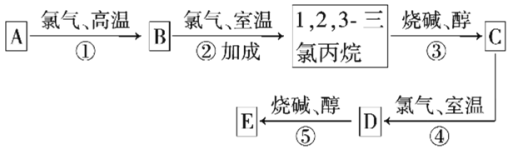
(1)利用题干中的信息推测有机物D的名称是___。
(2)写出下列反应的类型:反应①是__,反应③是__。
(3)有机物E的同类同分异构体共有___种(不包括E,不考虑空间异构)。
(4)试写出反应③的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的铜粉加入到 100 mL 某浓度的稀硝酸中,充分反应后,容器中剩有 m1g 铜粉,此时共收集到 NO 气体 448mL(标准状况).然后向上述混合物中加入足量稀硫酸至不再反应为止,容器仍剩有铜粉 m2g,则(m1-m2)为( )
A.2.88B.5.76C.7.2D.11.52
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铬盐厂净化含Cr(Ⅵ)废水并提取Cr2O3的一种工艺流程如图所示。
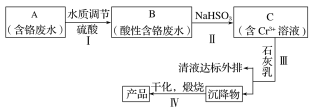
已知:Ksp[Cr(OH)3]=6.3×10-31
Ksp[Fe(OH)3]=2.6×10-39
Ksp[Fe(OH)2]=4.9×10-17
(1)步骤Ⅰ中,发生的反应为2H++2CrO42-![]() Cr2O72-+H2O,B中含铬元素的离子有___(填离子符号)。
Cr2O72-+H2O,B中含铬元素的离子有___(填离子符号)。
(2)当清液中Cr3+的浓度≤1.5mg·L-1时,可认为已达铬的排放标准。若测得清液的pH=5,则清液尚不符合铬的排放标准,因为此时Cr3+的浓度=__mg·L-1。
(3)步骤Ⅱ还可用其他物质代替NaHSO3作还原剂。
①若用FeSO4·7H2O作还原剂,步骤Ⅲ中参加反应的阳离子一定有__(填离子符号)。
②若用铁屑作还原剂,当铁的投放量相同时,经计算,C溶液的pH与c(Cr2O72-)的对应关系如下表所示:
pH | 3 | 4 | 5 | 6 |
c(Cr2O72-)/mol·L-1 | 7.02×10-21 | 7.02×10-7 | 1.25×10-3 | 2.21×10-34 |
有人认为pH=6时,c(Cr2O72-)变小的原因是Cr2O72-基本上都已转化为Cr3+。这种说法是否正确,为什么?___。
③用铁屑作还原剂时,为使所得产品中含铁元素杂质的含量尽可能低,需要控制的条件有___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com