
����Ŀ������˵����ȷ����(����)
A. ����ӵ����������������У��뽫�������ĸ����豸��ֱ����Դ�ĸ�������
B. ��ӦH2S(g)��ZnO(s)===H2O(g)��ZnS(s)��һ�������¿��Է����У��Ҧ�S<0����H>0
C. ���³�ѹ������ȼ�ϵ�ع�������2.24 L O2ʱ��ת�Ƶ��ӵ���ĿΪ0.4��6.02��1023
D. �����£�Ksp[Cu(OH)2]��2.6��10��19��pH��10�ĺ�Cu2������Һ�У�c(Cu2��)��2.6��10��11mol��L��1
���𰸡�A
��������
A. ��ӵ������������������õ��ǵ���ԭ����
B.��S��ָ������ѧ��Ӧʱ���ʻ��Ҷȵı仯��
C.�����������״̬δ֪��
D. ����Ksp[Cu(OH)2]�ı���ʽ������ɳ���ʱ��ͭ�������Ũ��c(Cu2��)��
A. ����ӵ����������������У��ѱ������ĸ����豸��ֱ����Դ�ĸ���������Ϊ���ص���������������A����ȷ��
B. ��ӦH2S(g)��ZnO(s)===H2O(g)��ZnS(s)��Ӧǰ�������������䣬����S = 0����B�����
C. ����ȼ�ϵ�ص��ܷ�ӦΪ2H2+O2![]() 2H2O�������ĵ�O2�����δָ���Ƿ��DZ�״�������������������ʵ���������ת��������C�����
2H2O�������ĵ�O2�����δָ���Ƿ��DZ�״�������������������ʵ���������ת��������C�����
D. �����£�pH��10�ĺ�Cu2������Һ�У�c(OH-) = ![]() =
= ![]() = 1��10-4�������Ksp[Cu(OH)2]��2.6��10��19��֪��c(Cu2��)�����Ũ��Ϊ
= 1��10-4�������Ksp[Cu(OH)2]��2.6��10��19��֪��c(Cu2��)�����Ũ��Ϊ![]() =
= ![]() = 2.6��10��11mol��L��1����c(Cu2��)�� 2.6��10��11mol��L��1����D�����
= 2.6��10��11mol��L��1����c(Cu2��)�� 2.6��10��11mol��L��1����D�����
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ṥҵ�����У�Ϊ��������SO2��ת�������ܳ���������ܣ��������м����Ƚ������ĽӴ��ң�����ͼ��������˵���������

A. a��b�����Ļ������ɷֺ�����ͬ���¶Ȳ�ͬ
B. c��d�����Ļ������ɷֺ�����ͬ���¶Ȳ�ͬ
C. �Ƚ�������������Ԥ�ȴ���Ӧ�����壬��ȴ��Ӧ�������
D. c�����徭�Ƚ������ٴδ�������Ŀ�������SO2��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ʵ����ˮ��������ij�������ۺϴ�����NH4+��ˮ��ҵ��������Ҫ��N2��CO2��SO2��NO��CO�������������ɷ֣���������������̣�
����˵������ȷ����

A. ����1����Ҫ����Ca(OH)2��CaCO3��CaSO3
B. X�����ǿ������������
C. ������������������Ҫ��CO
D. ������NH4+��ˮʱ��������Ӧ�����ӷ���ʽΪ��NH4++NO2-==N2��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(H2C2O4)�㷺������ʳƷ�У����Ƕ��估��ز�Ʒ�����������о���
��1��H2C2O4 (s) ![]() H2O(g)+CO(g)+CO2(g) ��H=+340kJ��mol-1��д���˷�Ӧ��ƽ�ⳣ������ʽ K= ���ܱ������У������¶Ȳ��䣬�����й�ѡ����ȷ���ǣ� ��
H2O(g)+CO(g)+CO2(g) ��H=+340kJ��mol-1��д���˷�Ӧ��ƽ�ⳣ������ʽ K= ���ܱ������У������¶Ȳ��䣬�����й�ѡ����ȷ���ǣ� ��
A������ʱ��������ѹǿ���ٱ仯��˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬
B����ѹʱ��������������ٱ仯��˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬
C������Ħ��������ٷ����仯��˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬
D������ƽ��Ħ���������ٷ����仯��˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬
��2������ֽ�����ȼ�Ͽ�����CO��ͨ�������Ʊ�CO��
CH4(g)+CO2(g) 2CO(g)+2H2(g) ��H >O�������£���2 L���ܱ�������ͨ��4 mol CH4�����6 mol CO2���巢����Ӧ��5min��ﵽƽ�⣬���CO�����Ũ��Ϊ0.1 mol��L-1��
��ƽ��ʱ���÷�Ӧ��ƽ����Ӧ����v(CO2)= mol��L-1min-1��
���ڲ��ı䷴Ӧ�����������ǰ���£�Ϊ�����CH4�����ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��
��3����ⱥ�Ͳ�����Һ�����Ƶøߵ�������ȩ��(H2C2O3)��װ������ͼ1��ʾ��д������Ĥ�缫�ĵ缫��Ӧʽ ��

��4����K3Fe(C2O4)3��Һ�д��ڣ�[Fe(C2O4)3]3-Fe3++3C2O42-�������£�����Һ��
[Fe(C2O4)3]3-��Ũ�����¶ȵĹ�ϵ����ͼ2��ʾ����A���c(Fe3+) B���c(Fe3+) (����<����>������=��)��������һ���º͵Ļ�ԭ���������������䣬��K3Fe(C2O4)3��Һ�м�������KMnO4���壬Fe3+��Ũ�� (��������������С������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ġ������̸���м��أ�������ժ��δ�죬ÿ����ľ����ö���룬��������������ɬζ�����������������ָ�� ��
A.����B.��ϩC.����D.������̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��װ�ý��е���Ӧʵ�飬�ܴﵽĿ�ĵ���(����)
A. 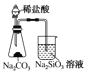 ֤���ǽ�����Cl>C>Si B.
֤���ǽ�����Cl>C>Si B.  ����Ȫ��ʵ��
����Ȫ��ʵ��
C.  ��ȡ���ռ����﴿����NH3 D.
��ȡ���ռ����﴿����NH3 D. 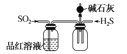 ̽��SO2�Ļ�ԭ�Ժ�Ư����
̽��SO2�Ļ�ԭ�Ժ�Ư����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����84������Һ����Ч�ɷ�ΪNaClO��������������Ư�ף�����ʵ������ķ���������ȷ���� ( )
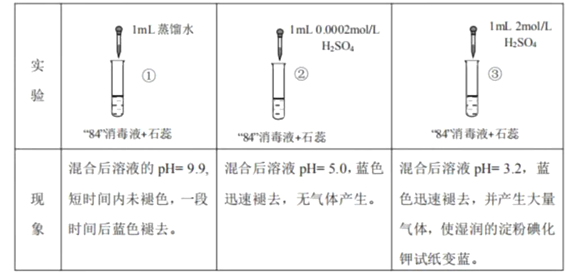
A. �Ա�ʵ��ٺ͢ڣ�������ɫѸ����ȥ��ԭ���Ƿ����˷�ӦClO+H+ ===HClO
B. ʵ����в�����������Cl2����HClO�ֽ�õ���2HClO===Cl2��+H2O
C. �Ա�ʵ��ںۣ͢���Һ��pH���ܻ�Ӱ��ClO �������Ի�Cl �Ļ�ԭ��
D. ���������ߡ�84������Һ��Ư��Ч��������Ҫ���غ��ʵ�pH���ܰ�ȫʹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����������ԼΪ1.0L�ĺ����ܱ������з�����Ӧ��2CH3OH(g)![]() CH3OCH3(g)��H2O(g)
CH3OCH3(g)��H2O(g)
���� | �¶ȣ����� | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
�� | 387 | 0.40 | ||
�� | 207 | 0.20 | 0.090 | 0.090 |
����˵����ȷ����
A���÷�Ӧ������ӦΪ���ȷ�Ӧ
B���ﵽƽ��ʱ������I�е�CH3OH����������������е�С
C������I�з�Ӧ�ﵽƽ������ʱ����������еij�
D������ʼʱ������I�г���CH3OH 0.1mol��CH3OCH3 0.15mol��H2O 0.10mol����Ӧ��������Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼����( Na2CO4)��һ�ֺܺõĹ�����������ϡ���ᷴӦ�Ļ�ѧ����ʽΪ��2Na2CO4+4HCl=4NaCl+2CO2 +O2+2H2O.���۹�̼����һ�㶼����̼���ƣ�Ϊ�ⶨij��̼������Ʒ(ֻ��Na2CO4��Na2CO3)�Ĵ��ȣ�ij��ѧ��ȤС������������ַ���ʵʩ��
����һ��![]()
��1�����������������Ʒֱ�Ϊ
��2�����������У�ʹ�õ����������� __(��������)��
��3��������������IJ�������
������������ͼ��װ��ʵ��װ�ã�QΪһ��������������ȡ������Ʒ�����У���Һ©����������ϡ�����������������ַ�Ӧ��

��4��Ϊ�ⶨ��Ӧ������������������ϡ����ǰ����ر� ���� (����K1������K2������K3��)������a�������� ��
��5����������Ӧֹͣ��ʹK1��K3���ڹر�״̬��K2���ڴ�״̬���ٻ�����Kl�� B��װ�Ĺ����Լ��� ��Ϊ��Ҫ������K1�� ��
��6��ʵ�����ʱ����ͲI����xmLˮ����Ͳ�����ռ�����ymL���壬����Ʒ�й�̼���Ƶ����������� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com