
【题目】下列有关实验装置进行的相应实验,能达到目的的是( )
A. 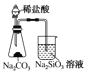 证明非金属性Cl>C>Si B.
证明非金属性Cl>C>Si B.  “喷泉”实验
“喷泉”实验
C.  制取并收集干燥纯净的NH3 D.
制取并收集干燥纯净的NH3 D. 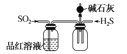 探究SO2的还原性和漂白性
探究SO2的还原性和漂白性
【答案】B
【解析】
A. 稀盐酸易挥发,干扰了C、Si非金属性强弱判断,且稀盐酸不是含氧酸;
B. 氯气与氢氧化钠溶液反应,可形成压强差;
C. 氨气的密度小于空气,应该采用向下排空气法收集;
D. 二氧化硫与硫化氢生成S单质,二氧化硫表现了氧化性。
A. 盐酸不是最高价氧化物对应水化物的含氧酸,且挥发出的盐酸能够使硅酸钠变浑浊,图示装置无法达到实验目的,故A项错误;
B. 图示装置中NaOH溶液与氯气反应,是瓶内气压骤降,可完成喷泉实验,故B项正确;
C. NH3的密度较小,应该采用向下排空气法收集,图中为向上排空气法,故C项错误;
D. SO2与硫化氢的反应中,二氧化硫的S元素化合价降低,表现的是氧化性,而不是还原性,故D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。
完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加。
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。
(3)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”“小于”或“等于”)
等浓度广东草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
a.[H+]>[HC2O4-]>[HCO3-]>span>[CO32-] b.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c.[H+]>[HC2O4-]>[C2O42-]>[CO32-] d.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-![]() H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2 II
CO(g)+H2O(g) △H2 II
某实验室控制CO2和H2初始投料比为1︰2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJmol-1和-285.8kJmol-1。
②H2O(l)=H2O(g) △H3=+44.0kJmol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=______;反应II的△H2=______kJmol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有__________。
A.使用催化剂Cat.1 B.使用催化剂Cat.2
C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大 CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___________________________。
(4)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图_________。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在______极,该电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究外界条件对锌与稀硫酸反应速率的影响,设计如下方案:
编号 | 纯锌粉 | 0. 2 mol·L-1硫酸溶液 | 温度 | 硫酸铜固体 |
Ⅰ | 2. 0 g | 200. 0 mL | 25 ℃ | 0 |
Ⅱ | 2. 0 g | 200. 0 mL | 35 ℃ | 0 |
Ⅲ | 2. 0 g | 200. 0 mL | 35 ℃ | 0. 2 g |
下列叙述不正确的是
A. Ⅰ和Ⅱ实验探究温度对反应速率的影响
B. Ⅱ和Ⅲ实验探究原电池对反应速率的影响
C. 反应速率Ⅲ>Ⅱ>Ⅰ
D. 实验Ⅰ、Ⅱ、Ⅲ的变化图象如图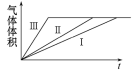
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在外加电流的阴极保护法中,须将被保护的钢铁设备与直流电源的负极相连
B. 反应H2S(g)+ZnO(s)===H2O(g)+ZnS(s)在一定条件下可自发进行,且ΔS<0,则ΔH>0
C. 常温常压,氢氧燃料电池工作消耗2.24 L O2时,转移电子的数目为0.4×6.02×1023
D. 常温下,Ksp[Cu(OH)2]=2.6×10-19,pH=10的含Cu2+的溶液中,c(Cu2+)≥2.6×10-11mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质沸点由高到低的顺序是
①正丁烷 ②2—甲基丙烷 ③丙烷 ④2,2—二甲基丙烷
A. ④②①③B. ④①②③C. ②④①③D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取2.3g金属钠投入到100g水中,所得溶液的密度为1.022g/cm3。
(1)写出钠与水反应的化学方程式并标出电子转移的方向和数目;_________。
(2)该反应的还原剂是____________,还原产物是______________。
(3)求反应后产生的气体在标准状况下的体积和所得溶液的物质的量浓度。______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各图曲线表征的信息。得出的结论正确的是
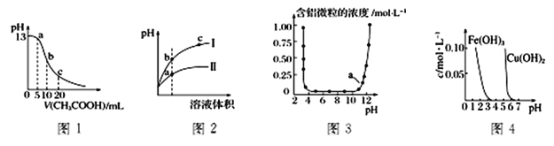
A. 图1表示常温下向体积为10mL0.1 molL-1NaOH溶液中逐滴加入0.1 molL-1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B. 图2表示用水稀释pH相同的盐酸和NH4C1溶液时。溶液的pH变化曲线,其中Ⅰ表示盐酸,Ⅱ表示NH4C1溶液,且溶液导电性:b>c>a
C. 图3表示的是Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
D. 由图4得出若除去Fe2(SO4)3溶液中的Cu2+,可采用向溶液中加入适量Fe2O3,调节溶液的pH 至4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:

(1)化合物A是由⑤⑧两种元素构成的,用电子式表示其形成过程______________
(2)④、⑦元素形成的化合物中,⑦的原子数与④、⑦间的化学键个数之比___________________
(3)②的最简单氢化物与氧气可以设计成燃料电池,写出在碱性条件下负极的电极方程式_____________________________________
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

a、⑥的单质与⑤的最高价氧化物对应水化物的水溶液反应的离子方程式为:___________________;
b、M中所含化学键的类型___________________________________;
c、M中的阳离子的鉴定方法是_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com