
����Ŀ���±�ΪԪ�����ڱ���һ���֣��û�ѧ����ش��������⣺

��1��������A���ɢݢ�����Ԫ�ع��ɵģ��õ���ʽ��ʾ���γɹ���______________
��2���ܡ���Ԫ���γɵĻ������У��ߵ�ԭ������ܡ���Ļ�ѧ������֮��___________________
��3���ڵ�����⻯��������������Ƴ�ȼ�ϵ�أ�д���ڼ��������¸����ĵ缫����ʽ_____________________________________
��4���ɱ���Ԫ���γɵij�������X��Y��Z��M��N�ɷ������·�Ӧ��

a���ĵ�����ݵ�����������Ӧˮ�����ˮ��Һ��Ӧ�����ӷ���ʽΪ��___________________��
b��M��������ѧ��������___________________________________��
c��M�е������ӵļ���������_______________________________________��
���𰸡�![]() 1:4 CH4-8e-+10OH-=CO32-+7H2O 2 Al + 2OH- + 2H2O=2AlO2- + 3H2�� ���Ӽ����ۼ� ȡ��Ʒ���Թ��У���������������Һ�����ȣ�����ʹʪ��ĺ�ɫʯ����ֽ�����Ĵ̼�����ζ���壬˵������NH4+
1:4 CH4-8e-+10OH-=CO32-+7H2O 2 Al + 2OH- + 2H2O=2AlO2- + 3H2�� ���Ӽ����ۼ� ȡ��Ʒ���Թ��У���������������Һ�����ȣ�����ʹʪ��ĺ�ɫʯ����ֽ�����Ĵ̼�����ζ���壬˵������NH4+
��������
��Ԫ�������ڱ���λ�ã���֪��ΪH����ΪC����ΪN����ΪO����ΪNa����ΪAl����ΪSi����Ϊ��
��1��������A���ɢݢ�����Ԫ�ع��ɵģ���Ϊ�Ȼ��ƣ��û�����Ϊ���ӻ����Na��Cl֮��ͨ����ʧ���Ӷ��γ����Ӽ����ݴ�����
��2������������һ����ԭ�ӿ��γ�4������������
��3���������ȼ�ϵ���У���������ʧ���ӣ�����������Ӧ��
��4��a���ĵ���ΪAl���ݵ�����������Ӧˮ����ΪNaOH�����߷�Ӧ����ƫ��������������
b��MΪ�Ȼ�泥�Ϊ���ӻ����
c��M�е�������Ϊ笠����ӣ����ݳ��������ӵļ��鷽����������
��1������A���ɢݢ�����Ԫ�ع��ɵģ���ΪNaCl�������ʽ��ʾ���γɹ���Ϊ��
![]() ��
��
�ʴ�Ϊ��![]() ��
��
��2����ΪO����ΪSi���������γɵĻ�����Ϊ�������裬�û�����Ϊԭ�Ӿ��壬�侧���ڲ�һ����ԭ�ӿ��γ�4��Si-O�������ԭ�Ӹ����뻯ѧ��֮��Ϊ1:4��
�ʴ�Ϊ��1��4��
��3���ڵ�����⻯��Ϊ���飬������������Ƴɼ���ȼ�ϵ�أ��为����ӦʽΪ��CH4-8e-+10OH-=CO32-+7H2O��
�ʴ�Ϊ��CH4-8e-+10OH-=CO32-+7H2O��
��4��a���ĵ���ΪAl���ݵ�����������Ӧˮ����ΪNaOH���䷴Ӧ�����ӷ���ʽΪ��2Al + 2OH- + 2H2O=2AlO2- + 3H2����
�ʴ�Ϊ��2Al + 2OH- + 2H2O=2AlO2- + 3H2����
b��MΪ�����ǽ���Ԫ�ص��Σ������֪MΪ�Ȼ�泥��仯ѧ������Ϊ���Ӽ����ۼ���
�ʴ�Ϊ�����Ӽ����ۼ���
c��M�е�������Ϊ笠����ӣ�����鷽��Ϊ��ȡ��Ʒ���Թ��У���������������Һ�����ȣ�����ʹʪ��ĺ�ɫʯ����ֽ�����Ĵ̼�����ζ���壬˵������NH4+��
�ʴ�Ϊ��ȡ��Ʒ���Թ��У���������������Һ�����ȣ�����ʹʪ��ĺ�ɫʯ����ֽ�����Ĵ̼�����ζ���壬˵������NH4+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��װ�ý��е���Ӧʵ�飬�ܴﵽĿ�ĵ���(����)
A. 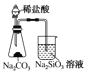 ֤���ǽ�����Cl>C>Si B.
֤���ǽ�����Cl>C>Si B.  ����Ȫ��ʵ��
����Ȫ��ʵ��
C.  ��ȡ���ռ����﴿����NH3 D.
��ȡ���ռ����﴿����NH3 D. 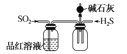 ̽��SO2�Ļ�ԭ�Ժ�Ư����
̽��SO2�Ļ�ԭ�Ժ�Ư����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ܱ������г�������ʵ�����A��B��һ���¶��·�����ӦA(g)��xB(g)![]() 2C(g)���ﵽƽ����ڲ�ͬ��ʱ��Σ��ֱ�ı䷴Ӧ��һ����������������и����ʵ����ʵ���Ũ�ȡ���Ӧ���ʷֱ���ʱ��ı仯��ͼ��ʾ��
2C(g)���ﵽƽ����ڲ�ͬ��ʱ��Σ��ֱ�ı䷴Ӧ��һ����������������и����ʵ����ʵ���Ũ�ȡ���Ӧ���ʷֱ���ʱ��ı仯��ͼ��ʾ��


����˵������ȷ����
A. 30��40 min��÷�Ӧʹ���˴���
B. ��Ӧ����ʽ�е�x��1������ӦΪ���ȷ�Ӧ
C. 30 minʱ�����¶ȣ�40 minʱ�����¶�
D. 30 minʱ��Сѹǿ��40 minʱ�����¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϼ���Դ���ʡ�
(1)����CO2��H2�ڴ����������ºϳɼ״�����������Ҫ��Ӧ����:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)����H2=-58 kJ��mol-1����ij�¶�ʱ����1. 0 mol CO ��2. 0 mol H2����2 L�Ŀո�ƿ�У�����������Ӧ���ڵ�5 min ʱ�ﵽ��ѧƽ��״̬����ʱ�״������ʵ�������Ϊ10%���״�Ũ�ȵı仯״����ͼ��ʾ:
CH3OH(g)+H2O(g)����H2=-58 kJ��mol-1����ij�¶�ʱ����1. 0 mol CO ��2. 0 mol H2����2 L�Ŀո�ƿ�У�����������Ӧ���ڵ�5 min ʱ�ﵽ��ѧƽ��״̬����ʱ�״������ʵ�������Ϊ10%���״�Ũ�ȵı仯״����ͼ��ʾ:

�ٴӷ�Ӧ��ʼ��5 min ʱ�����ɼ״���ƽ������Ϊ________��5 min ʱ����ʼʱ������ѹǿ��Ϊ______��
��5 min ʱ�ﵽƽ�⣬H2��ƽ��ת���ʦ�=______%����ѧƽ�ⳣ��K=______��
��1 min ʱ��v(��)(CH3OH)________4 minʱv(��)(CH3OH ) (����ڡ���С�ڡ����ڡ�)��
��������ƿ����ͬ�ݻ��ľ��ȸ�ƿ���ظ�����ʵ�飬ƽ��ʱ�״������ʵ�������________10%(�>����<����=��)��
(2)��ͼ�Ǽ״�ȼ�ϵ�ع�����ʾ��ͼ������A��B��D��Ϊʯī�缫��CΪͭ�缫������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ��

�ټ��и����ĵ缫��ӦʽΪ______________________��
������A�������������ڱ�״���µ����Ϊ________��
�۱�װ����Һ�н��������ӵ����ʵ�����ת�Ƶ��ӵ����ʵ����仯��ϵ����ͼ����ͼ�Т��߱�ʾ����____�ı仯����Ӧ������Ҫʹ��װ���н���������ǡ����ȫ��������Ҫ____ mL 5. 0 mol��L-1 NaOH��Һ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼����( Na2CO4)��һ�ֺܺõĹ�����������ϡ���ᷴӦ�Ļ�ѧ����ʽΪ��2Na2CO4+4HCl=4NaCl+2CO2 +O2+2H2O.���۹�̼����һ�㶼����̼���ƣ�Ϊ�ⶨij��̼������Ʒ(ֻ��Na2CO4��Na2CO3)�Ĵ��ȣ�ij��ѧ��ȤС������������ַ���ʵʩ��
����һ��![]()
��1�����������������Ʒֱ�Ϊ
��2�����������У�ʹ�õ����������� __(��������)��
��3��������������IJ�������
������������ͼ��װ��ʵ��װ�ã�QΪһ��������������ȡ������Ʒ�����У���Һ©����������ϡ�����������������ַ�Ӧ��

��4��Ϊ�ⶨ��Ӧ������������������ϡ����ǰ����ر� ���� (����K1������K2������K3��)������a�������� ��
��5����������Ӧֹͣ��ʹK1��K3���ڹر�״̬��K2���ڴ�״̬���ٻ�����Kl�� B��װ�Ĺ����Լ��� ��Ϊ��Ҫ������K1�� ��
��6��ʵ�����ʱ����ͲI����xmLˮ����Ͳ�����ռ�����ymL���壬����Ʒ�й�̼���Ƶ����������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ɳ��������һ�ֳ�Чƽ��ҩ����ϳɵIJ���·�����£�

(1)F�еĺ�������������Ϊ____________(д����)��
(2)C��D�ķ�Ӧ����Ϊ____________��
(3)B�ķ���ʽΪC8H8O3����(CH3)2C(OCH3)2����ȡ����Ӧ�õ�����C��CH3OH��д��B�Ľṹ��ʽ��________��
(4)д��ͬʱ��������������E��һ��ͬ���칹��Ľṹ��ʽ��__________��
�ٷ����к��б���������һ������̼ԭ�ӣ�������FeCl3������ɫ��Ӧ��
���ܷ���ˮ�ⷴӦ��ˮ�����֮һ�Ǧ������ᣬ��һ��������ˮ����������ֻ��3�ֲ�ͬ��ѧ�������⡣
(5)��д���� ��(CH3)2C(OCH3)2��CH3NO2Ϊԭ���Ʊ�
��(CH3)2C(OCH3)2��CH3NO2Ϊԭ���Ʊ� �ĺϳ�·������ͼ(���Լ����ã��ϳ�·������ͼʾ�����������) _____��
�ĺϳ�·������ͼ(���Լ����ã��ϳ�·������ͼʾ�����������) _____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ж�HA���������(����)��������
A. Ũ����ȵ�HCl��HA����Һ���Ƚ�c(H��) ��HClԼ��HA��100��
B. pH��ȵ�HCl��HA����Һ��c(HA)Լ��c(HCl)��100��
C. Ũ����ȵ�HCl��HA����Һ�����ͬʱ����þ��Ӧ��������HA��HCl��
D. pH��ȵ�HCl��HA����Һ�����ͬʱ����þ��Ӧ��������HA��HCl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л�ѧʵ��ʾ��ͼ������ʵ�����������Ϸ����ó��Ľ�����ȷ����

ѡ�� | ʵ�� | ʵ������ | ���� |
A | a | ���ձ��������������ݣ����ձ���ͭ���������� | ��ԣ�Al��Fe��Cu |
B | b | �������Ϊ��ɫ���ұ�����Ϊ��ɫ | �����ԣ�Cl2��Br2��I2 |
C | c | ��ɫ�����ȱ�Ϊ����ɫ�����Ϊ��ɫ | �ܽ��:AgCl < AgBr < Ag2S |
D | d | ��ƿ��������������ձ���Һ������ | �ǽ����ԣ�Cl��C��Si |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com