
【题目】根据下列各图曲线表征的信息。得出的结论正确的是
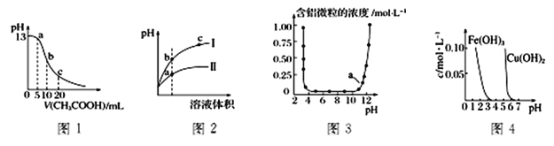
A. 图1表示常温下向体积为10mL0.1 molL-1NaOH溶液中逐滴加入0.1 molL-1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B. 图2表示用水稀释pH相同的盐酸和NH4C1溶液时。溶液的pH变化曲线,其中Ⅰ表示盐酸,Ⅱ表示NH4C1溶液,且溶液导电性:b>c>a
C. 图3表示的是Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
D. 由图4得出若除去Fe2(SO4)3溶液中的Cu2+,可采用向溶液中加入适量Fe2O3,调节溶液的pH 至4左右
【答案】A
【解析】A、体积10mL0.1![]() 溶液中逐滴加入0.1
溶液中逐滴加入0.1![]()
![]() 溶液后,所得的溶液是醋酸钠溶液,存在质子守恒
溶液后,所得的溶液是醋酸钠溶液,存在质子守恒![]() ,故A正确。
,故A正确。
用水稀释pH相同的盐酸和NH4Cl,盐酸的pH变化较大, NH4Cl的pH变化小,溶液的导电能力取决于自由移动离子的浓度的大小,即其中Ⅰ表示盐酸,Ⅱ表示NH4Cl,且溶液导电性:a>b>c,故B错误;
C、Al3+与OH-反应时,先生成氢氧化铝沉淀,而后沉淀溶解生成偏铝酸根,a点对应的碱性较强,铝元素应以偏铝酸根的形式存在。故C错误
若除去Fe2(SO4)3溶液中的Cu2+,加入适量Fe2O3,调节溶液的pH 至4左右,此时会生成氢氧化铁沉淀,不能除去Cu2+,反而把Fe3+除去,故D错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】喹啉醛H 是一种可用于制备治疗肿瘤药物的中间体。由烃A制备H的合成路线如下:
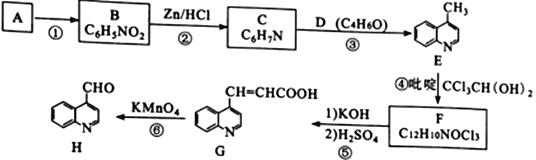
巳知:i.RCCl3![]() RCOOK;ii.反应④中,吡啶作稳定剂
RCOOK;ii.反应④中,吡啶作稳定剂
回答下列问题:
(1)A的化学名称是__________________________。
(2)①、⑥的反应类型分别为_______________、________________。
(3)D为链状结构,分子中不含“—O—”结构,且不能发生银镜反应,其核磁共振氢谱为3组峰,峰面积比为3:2:1,D的结构简式为________________________。
(4)反应④的化学方程式为______________________________________。
(5)下列有关G的说法正确的是________________ (填标号)。
a.经质谱仪测定,G只含有羧基、碳碳双健两种官能团
b.属于萘的衍生物
c.一定条件下可发生加聚反应
d.可与少量Na2CO3溶液反应生成NaHCO3
(6)X是H的同分异构体,两者环状结构相同,X环上的取代基与H的相同但位置不同,则X可能的结构有____种。
(7)写出用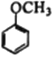 为原料制备
为原料制备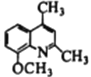 的合成路线________________(其他试剂任选)。
的合成路线________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023
B. 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
C. 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D. 一定条件下反应N2+3H22NH3达到平衡时,3v正(H2)=2v逆(NH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组按如下流程,进行海带中碘含量的测定和碘的制取等实验。
I. 碘含量的测定

(1)步骤①是将海带置于__________中(填仪器名称)进行灼烧。
(2)步骤④是将溶液转移至________________(填定容仪器的名称)。
(3)取20.00mL 上述海带浸取原液,加稀H2SO4和足量KIO3,使![]() 和
和![]() 完全反应(
完全反应(![]() )。再以淀粉为指示剂,用
)。再以淀粉为指示剂,用![]() mol/L的Na2S2O3溶液滴定(
mol/L的Na2S2O3溶液滴定(![]() ),当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。
),当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。
(4)判断用Na2S2O3溶液滴定恰好完全反应的现象是__________________________。
(5)计算该干海带中碘的质量分数_________________。
II. 碘的制取
另制海带浸取原液,按如下方案制取碘:
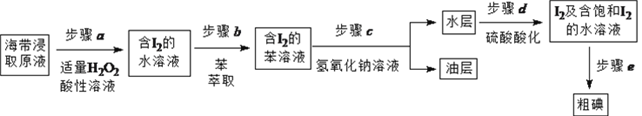
(1)补全步骤![]() 的反应方程式,配平并标出电子转移的数目和方向。
的反应方程式,配平并标出电子转移的数目和方向。
![]() ,_______________
,_______________
(2)步骤![]() 加入足量NaOH溶液、振荡、静置后,油层在_____(填“上”或“下”)层,呈____色。
加入足量NaOH溶液、振荡、静置后,油层在_____(填“上”或“下”)层,呈____色。
(3)步骤![]() 的操作是_______________。
的操作是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是
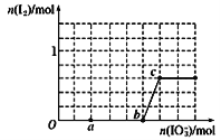
A. a点时NaHSO3过量
B. b点时还原产物为I-
C. b点到c点,KIO3与NaHSO3反应生成I2
D. 加入的KIO3为0.4mol或1.12mol时,I-均为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
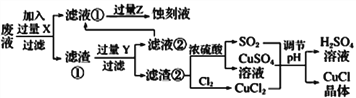
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在潮湿空气中易水解氧化;见光则分解,变成褐色;CuCl难溶于醇和水,可溶于氯离子浓度较大的体系。下图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)
根据以上信息回答下列问题:
(1)写出生产过程中所用物质的名称:____________,________________。
(2)写出产生CuCl的化学方程式:________________________________。
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由________________________________________________。实际生产中SO2要适当过量,原因可能是___(答一点即可).
(4)得到CuC1晶体后,还需要经过水洗、乙醇洗涤两步操作。用乙醇洗涤的作用是________________。
(5)实验探究pH对CuCl产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为_________,当pH较大时CuCl产率变低原因是________________。
(6)氯化亚铜的定量分析:
①称取样品0.25g和过量的FeCl3溶液于250mL锥形瓶中,充分溶解。
②用0.10molL-1硫酸铈标准溶液滴定。已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 | /tr>
则样品中CuCl的纯度为_______________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于SO2的叙述,正确的是( )
A.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
B.SO2是硫在空气中不完全燃烧的产物,SO3是硫在空气中完全燃烧的产物
C.大气中SO2的主要来源是汽车排出的尾气
D.SO2具有漂白性,因而可以使石蕊试液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关染发剂的说法错误的是( )
A.选择毒性、刺激性较小的染发剂,如植物性染发剂,减少染发剂对人体的伤害
B.染发时应严格遵守染发剂使用说明,不要混合使用不同的染发剂
C.尽量少染发,当头皮有伤口时不要染发
D.染完头发后,不必清洗多次次,以免影响染发效果
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com