
【题目】在含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是
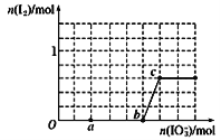
A. a点时NaHSO3过量
B. b点时还原产物为I-
C. b点到c点,KIO3与NaHSO3反应生成I2
D. 加入的KIO3为0.4mol或1.12mol时,I-均为0.4mol
【答案】C
【解析】A项,![]() 在b点才反应完全,a点时过量,故A正确。B,由上述解释可以看出,b点时发生反应2IO3-+6HSO3-=2I-+6SO42-+6H+,
在b点才反应完全,a点时过量,故A正确。B,由上述解释可以看出,b点时发生反应2IO3-+6HSO3-=2I-+6SO42-+6H+,![]() 是氧化剂,其对应的产物
是氧化剂,其对应的产物![]() 为还原产物,故B正确。C,由于
为还原产物,故B正确。C,由于![]() 还原性强于
还原性强于![]() ,所以
,所以![]() 比
比![]() 先与
先与![]() 发生氧化还原反应。b点时加入的
发生氧化还原反应。b点时加入的![]() 物质的量为1mol,和3mol
物质的量为1mol,和3mol![]() 的溶液恰好完全反应,即 2IO3-+6HSO3-=2I-+6SO42-+6H+,b点到c点,
的溶液恰好完全反应,即 2IO3-+6HSO3-=2I-+6SO42-+6H+,b点到c点,![]() 可以结合
可以结合![]() 氧化
氧化![]() 生成
生成![]() ,离子方程式是
,离子方程式是![]() ,在C点时,
,在C点时,![]() 与
与![]() 反应恰好生成
反应恰好生成![]() ,故C错误。D,加入的
,故C错误。D,加入的![]() 为0.4mol,发生反应:2IO3-+6HSO3-=2I-+6SO42-+6H+,生成
为0.4mol,发生反应:2IO3-+6HSO3-=2I-+6SO42-+6H+,生成![]() 为0.4mol,加入的
为0.4mol,加入的![]() 为1.12mol时,先发生反应2IO3-+6HSO3-=2I-+6SO42-+6H+:,3mol
为1.12mol时,先发生反应2IO3-+6HSO3-=2I-+6SO42-+6H+:,3mol![]() 消耗
消耗![]() 1mol,同时生成
1mol,同时生成![]() 1mol,然后发生反应
1mol,然后发生反应![]() ,剩余的0.12mol
,剩余的0.12mol![]() 消耗碘离子0.6mol,所以剩余的
消耗碘离子0.6mol,所以剩余的![]() 也是0.4mol,故D正确。本题正确选项为C。
也是0.4mol,故D正确。本题正确选项为C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有下列几种物质:A.石墨和金刚石 B. 35Cl和37Cl C.CH3CH=CHCH3和(CH3)2C=CH2 D.丁烷和新戊烷E. 
(1)属于同素异形体的是__________________
(2)属于同位素的是__________________
(3)属于同分异构体的是__________________
(4)属于同系物的是__________________
(5)属于同种物质的是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法是还原沉淀法。该法的工艺流程为:
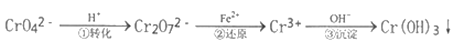
已知:CrO42-(黄色)、Cr2O72- (橙色)
(1)用离子方程式表示第①步可逆反应转化过程___________________。
(2)用离子方程式表示第②步还原反应转化过程___________________。
(3)能说明第①步反应达平衡状态的是_________。
a.Cr2O72-和CrO42-的浓度不变 b.2V(Cr2O72-) =V(CrO42-) c.溶液的颜色不变
(4)第②步中,还原1.5mol Cr2O72-离子,需要_______mol的FeSO47H2O。
(5)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr (OH)3 (s)![]() Cr3+ (aq) +3OH- (aq)。常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-) = 10-32,要使0.01mol/Lc(Cr3+)开始沉淀,溶液的pH应调至__________,若使c(Cr3+)降至10-5mol/L,溶液的pH应调至___________。
Cr3+ (aq) +3OH- (aq)。常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-) = 10-32,要使0.01mol/Lc(Cr3+)开始沉淀,溶液的pH应调至__________,若使c(Cr3+)降至10-5mol/L,溶液的pH应调至___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某些肉类的加工过程中需要用盐渍(把较多的食盐撒在肉制品表面,腌制一段时间),以防肉类变质.其原因是
A. 食盐中的氯离子有杀菌作用
B. 由于渗透而使肉质细腻
C. 浓盐水中氧气的含量少,致使细菌无法生存
D. 由于细菌细胞膜的渗透作用使细菌失水而死亡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各图曲线表征的信息。得出的结论正确的是
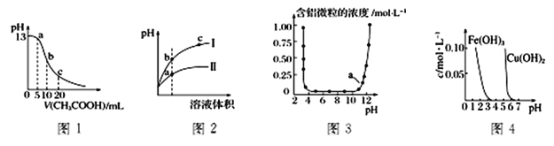
A. 图1表示常温下向体积为10mL0.1 molL-1NaOH溶液中逐滴加入0.1 molL-1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B. 图2表示用水稀释pH相同的盐酸和NH4C1溶液时。溶液的pH变化曲线,其中Ⅰ表示盐酸,Ⅱ表示NH4C1溶液,且溶液导电性:b>c>a
C. 图3表示的是Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
D. 由图4得出若除去Fe2(SO4)3溶液中的Cu2+,可采用向溶液中加入适量Fe2O3,调节溶液的pH 至4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组依据Mg与CO2的反应。推测Mg 与SO2在隔绝空气的条件下反应后,剩余固体M可能含有MgO、S、MgS、Mg中的一种或几种。为了验证推测,进行以下实验。请回答有关问题。
实验一:按如图所示进行实验。
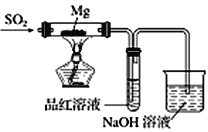
(1)实验室制取二氧化硫的化学方程式为 _________________________________。
(2)上述装置存在不合理之处,请提出一项改进建议 :___________________________。
(3)实验时,先通入SO2直到_______现象出现后,再点燃酒精灯;此操作目的是__________________。
实验二 确定固体M的成分。
实验装置如下图所示。将分液漏斗中稀硫酸(足量)加入到烧瓶中,完全反应后,实验现象如下: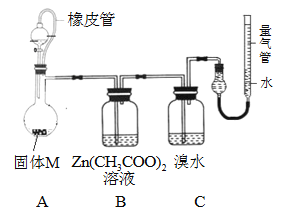
装置 | A | B | C | 量气管 |
现象 | 有残留固体 | 产生白色ZnS沉淀 | 溴水未褪色 | 进入气体v mL(标况) |
(4)实验时,B装置中反应的化学方程式为 __________________________________。
(5)已知镁的相对原子质量为24,则固体M中金属镁的质量为 _________g;实验前装置内有空气,对金属镁质量的测定结果的影响是 ____________(填“偏低”、“偏高”、“无影响”);
(6)依据以上实验,可确定固体M的成分有_________种(填数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕集CO2的技术对解决全球温室效应意义重大。目前国际空间站处理CO2的一个重要方法是将CO2还原,涉及的化学反应如下:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)+Q(Q>0)
CH4(g)+2H2O(g)+Q(Q>0)
完成下列填空:
(1)该反应的平衡常数表达式为________________________________。如果改变某种条件,平衡向正反应方向移动,则平衡常数________(填写编号)。
a、一定增大 b、一定减小 c、可能增大 d、可能减小 e、可能不变
(2)为了提高CO2的捕获百分率,可采取的措施是____________________。(任写一条)
(3)向2L某密闭容器充入1mol CO2和4mol H2,一定条件下发生上述反应。5min末测得气体的物质的量减少了20%,则0~5min内CO2的平均反应速率为_______________。CO2还可应用于纯碱工业。工业生产纯碱的过程中,向饱和的氨化食盐水中通入足量CO2的生产环节又被称为“碳酸化”。
(4)碳酸化时产生的现象是____________________________。碳酸化过程中,溶液中c(CO32-)的变化情况为____________________。
(5)碳酸化后过滤,留在滤液中的阳离子主要有_______________(填写化学式)。简述检验滤液中Cl- 离子的实验操作。________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和铍的性质十分相似, 下列关于铍性质推断不正确的是( )
A.氧化铍能与强酸或强碱起反应B.氢氧化铍可溶于水
C.氢氧化铍是两性氢氧化物D.氯化铍溶液显酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com