
����Ŀ���Ȼ���ͭ(CuCl)�������л��ϳɹ�ҵ�еĴ������ڳ�ʪ��������ˮ��������������ֽ⣬��ɺ�ɫ��CuCl�����ڴ���ˮ��������������Ũ�Ƚϴ����ϵ����ͼ�ǹ�ҵ��������ӡˢ��·�ķ�Һ����Fe3+��Cu2+��Fe2+��Cl-��
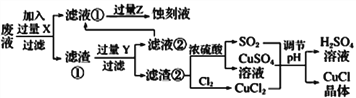
����������Ϣ�ش��������⣺
��1��д�������������������ʵ����ƣ�____________��________________��
��2��д������CuCl�Ļ�ѧ����ʽ��________________________________��
��3����CuCl�����ɹ����������ϲ���Ҫ����SO2���壬��ϻ�ѧ����ʽ�ͱ�Ҫ������˵������________________________________________________��ʵ��������SO2Ҫ�ʵ�������ԭ�������___����һ�㼴�ɣ���
��4���õ�CuC1�������Ҫ����ˮϴ���Ҵ�ϴ���������������Ҵ�ϴ�ӵ�������________________��
��5��ʵ��̽��pH��CuCl���ʵ�Ӱ�����±���ʾ��
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl���� | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
����CuCl�������pHΪ_________����pH�ϴ�ʱCuCl���ʱ��ԭ����________________��
��6���Ȼ���ͭ�Ķ���������
�ٳ�ȡ��Ʒ0.25g������FeCl3��Һ��250mL��ƿ�У�����ܽ⡣
����0.10molL-1���������Һ�ζ�����֪��CuCl+FeCl3�TCuCl2+FeCl2��Fe2++Ce4+�TFe3++Ce3+������ƽ��ʵ�������£�ƽ��ʵ�������ܳ���1%����
ƽ��ʵ����� | 1 | 2 | 3 |
0.25g��Ʒ�������������Һ�������mL�� | 24.35 | 24.05 | 23.95 | /tr>
����Ʒ��CuCl�Ĵ���Ϊ_______________�����������λ��Ч���֣���
���𰸡� �� ϡ���� CuCl2��CuSO4��SO2��2H2O===2CuCl����2H2SO4 ��ӦCu��2H2SO4(Ũ)![]() CuSO4��SO2����2H2O�����ɵ�CuSO4�� SO2Ϊ1��1�����������ϲ���Ҫ����SO2���� �� ��ϴ�����ӿ�ȥ��CuCl����ˮ�֣���ֹ��ˮ������ 2 pH�ϴ�ʱ��Cu2��ˮ��̶�����Ӧ���ɵ�CuCl���� 0.955(��95.5%)
CuSO4��SO2����2H2O�����ɵ�CuSO4�� SO2Ϊ1��1�����������ϲ���Ҫ����SO2���� �� ��ϴ�����ӿ�ȥ��CuCl����ˮ�֣���ֹ��ˮ������ 2 pH�ϴ�ʱ��Cu2��ˮ��̶�����Ӧ���ɵ�CuCl���� 0.955(��95.5%)
��������(1)ӡˢ��·�ķ�Һ(��![]() ��
��![]() ��
��![]() ��
��![]() ������,�����������ܹ�ԭ����Ӧ���ɶ���������,ͭ�����ܹ�������Ӧ����ͭ,���˺������к���ͭ����,��������,�������ᷴӦ�����Ȼ�����,ͭ�������Ӧ,��ͭ�����������ˣ����õ����������ۡ�ϡ���ᡣ
������,�����������ܹ�ԭ����Ӧ���ɶ���������,ͭ�����ܹ�������Ӧ����ͭ,���˺������к���ͭ����,��������,�������ᷴӦ�����Ȼ�����,ͭ�������Ӧ,��ͭ�����������ˣ����õ����������ۡ�ϡ���ᡣ
(2)����ͼʾ����֪��: CuCl2��CuSO4��SO2��H2O��Ӧ����H2SO4��CuCl,���ݵ�ʧ�����غ��䷽��ʽΪ: CuCl2��CuSO4��SO2��2H2O===2CuCl����2H2SO4
(3)����ͼʾ����֪��: ��ӦCu��2H2SO4(Ũ)![]() CuSO4��SO2����2H2O
CuSO4��SO2����2H2O
��Ӧ�����ɵ�CuSO4��SO2Ϊ1:1,���������ϲ���Ҫ����SO2����;
ʵ��������Ҫ�����ʵ�������![]() ,Ŀ�������
,Ŀ�������![]() �Ļ�ԭ����,ͬʱ���Է�ֹ���ɵ�
�Ļ�ԭ����,ͬʱ���Է�ֹ���ɵ�![]() ����������,
����������,
��4����ϴ�����ӿ�ȥ��CuCl����ˮ�֣���ֹ��ˮ������
��5��)����ͼ��CuCl���ʿ���֪��![]() �������Ϊ
�������Ϊ![]() ,��pH�ϴ�ʱCuCl���ʱ��,
,��pH�ϴ�ʱCuCl���ʱ��,![]() ˮ��̶�����,���ɵ�CuCl��;
ˮ��̶�����,���ɵ�CuCl��;
��6��������Ŀ���������ݼ�ƽ��ʵ�������ܳ���1%,���Ϊ![]() ,������ȥ,�ζ�
,������ȥ,�ζ�![]() ��Ʒ�������������Һ��ƽ�����
��Ʒ�������������Һ��ƽ�����![]() ,��Ϸ���ʽ����֪��:
,��Ϸ���ʽ����֪��:![]() �T
�T![]() ,
,![]() ,
,![]() CuCl�Ĵ���
CuCl�Ĵ���![]() ;
;


 ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǻ��������ʵ�飬��ش��й�����
ʵ�飺ͨ������ķ�����ȥ����ˮ�к��е������ӵ�������ȡ����ˮ����ͼ��ʾ
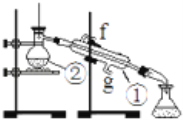
��1��д���������������ƣ���________��________��
��2������������װ�÷���ƾ������Ȼ�̼������Һ�Ļ�����ȱ�ٵ�������________��ͼ��װ���н�ˮ����________�����f����g����
��3���������г��������Ƭ����������Ŀ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ũ������Ҵ�����ϩ��װ����ͼ��ʾ�������в���������������ȷ���ǣ� ��
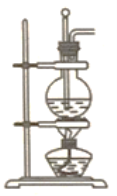
A. Բ����ƿ���ȼ�Ũ�����ټ����Ҵ�
B. ʵ��õ���������ʹ��ˮ��ɫ˵������ϩ����
C. ��Ӧ��Բ����ƿ�ڻ������ɫ����
D. ����ˮ���������ſ������ռ���ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и�ͼ���߱�������Ϣ���ó��Ľ�����ȷ����
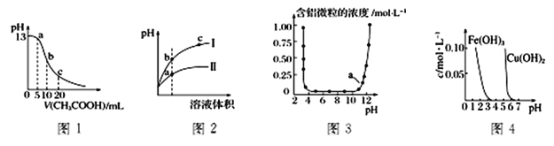
A. ͼ1��ʾ�����������Ϊ10mL0.1 molL-1NaOH��Һ����μ���0.1 molL-1CH3COOH��Һ����Һ��pH�仯���ߣ���b�㴦�У�c(CH3COOH)+c(H+)=c(OH-)
B. ͼ2��ʾ��ˮϡ��pH��ͬ�������NH4C1��Һʱ����Һ��pH�仯���ߣ����Т��ʾ���ᣬ���ʾNH4C1��Һ������Һ������:b>c>a
C. ͼ3��ʾ����Al3+��OH-��Ӧʱ������Ũ�ȱ仯���ߣ�ͼ��a����Һ�д�������Al3+
D. ��ͼ4�ó�����ȥFe2(SO4)3��Һ�е�Cu2+���ɲ�������Һ�м�������Fe2O3��������Һ��pH ��4����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��DΪԭ�������������������Ԫ�أ�A2-��B+������ͬ�ĵ��Ӳ�ṹ��C��DΪͬ����Ԫ�أ�C�������������������������3����DԪ���������һ��δ�ɶԵ��ӡ��ش��������⣺
��1������Ԫ���е縺��������_______________������Ԫ�ط��ţ�������Cԭ�ӵĺ�������Ų�ʽΪ__________________________��
��2������A������ͬ�������壬���зе�ߵ���___________(�����ʽ)��ԭ����___________________��A ��B�������������ľ������ͷֱ�Ϊ__________��___________��
��3��C��D��Ӧ��������ɱ�Ϊ1��3�Ļ�����E��E�����幹��Ϊ______________������ԭ�ӵ��ӻ��������Ϊ______________________��
��4��������D2A�����幹��Ϊ_____________������ԭ�ӵļ۲���Ӷ���Ϊ_______________������D��ʪ���Na2CO3��Ӧ���Ʊ�D2A���仯ѧ����ʽΪ____________________________________��
��5��A ��B�ܹ��γɻ�����F���侧���ṹ��ͼ��ʾ��F�Ļ�ѧʽΪ_____________��������Aԭ�ӵ���λ��Ϊ____________________��
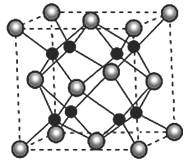
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.����ķ���ʽΪ C2H4OB.C6H6 һ���DZ�
C.�ǻ��ɱ�ʾΪ��OHD.ȩ���ɱ�ʾΪ��COH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������t��ʱ��ijNaOHϡ��Һ�У�c(H��)��10��a mol/L��c(OH��)��10��b mol/L����֪a��b��12����
(1)���¶���ˮ�����ӻ�����KW��________��
(2)��NaOH��Һ�����ʵ���Ũ�ȵľ�ȷֵ��________mol/L��
(3)�ڸ��¶��£���100 mL 0.1 mol/L��ϡ������100 mL 0.4 mol/L��NaOH��Һ��Ϻ���Һ��pH��________��
������Ũ�Ⱦ�Ϊ0.1 mol/L��������Һ�������ᡢ�ڴ��ᡢ���������ơ����Ȼ�李��ݴ���李�������李���������李��ఱˮ����ش��������⣺
(4)�١��ڡ��ۡ���������Һ����ˮ�������H��Ũ���ɴ�С��˳���� (�����)___________��
(5)�ܡ��ݡ��ߡ���������Һ��NH![]() Ũ���ɴ�С��˳���� (�����)_________________��
Ũ���ɴ�С��˳���� (�����)_________________��
(6)���ۺܵ͢������Ϻ��Һ�и�����Ũ�ȹ�ϵ��ȷ����________(����ĸ���)��
A��c(Na��)��c(Cl��)>c(OH��)>c(NH![]() )
)
B��c(Na��)��0.1 mol/L
C��c(Na��)��c(NH![]() )��c(Cl��)��c(OH��)
)��c(Cl��)��c(OH��)
D��c(H��)>c(OH��)
�����£�amol/L�Ȼ����Һ�м�������bmol/L����������Һ����Ӧ����Һ�����ԣ�����¶���NH3��H2O�ĵ��볣��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʹ������к͵ζ����ⶨ���۰״ĺ�����(g/100 mL)��
��ʵ�鲽�裺
(1)��ȡ10.00 mLʳ�ð״ף����ձ�����ˮϡ�ͺ�ת�Ƶ�100 mL________(����������)�ж��ݣ�ҡ�ȼ��ô���״���Һ��
(2)����ʽ�ζ���ȡ����״���Һ20.00 mL����ƿ�У������еμ�2��________��ָʾ����
(3)��ȡʢװ0.1000 mol/L NaOH��Һ�ļ�ʽ�ζ��ܵij�ʼ���������Һ��λ������ͼ��ʾ�����ʱ�Ķ���Ϊ________mL��
![]()
(4)�ζ�����______________ʱ��ֹͣ�ζ�������¼NaOH��Һ���ն������ظ��ζ�3�Ρ�
��ʵ���¼
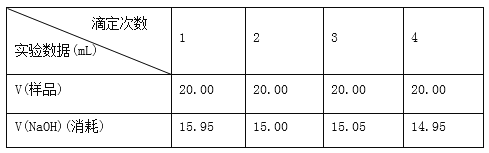
�����ݴ��������ۣ�
(1)����ȷ���ݴ������ɵ����۰״�������________g/100 mL(���������λ��Ч����)��
(2)��ͬѧ��ϸ�о��˸�Ʒ�ư״ı�ǩ���������л����б���������ΪʳƷ���Ӽ������������Ϸ���֤�����뱽�����Ʋ��ᷢ�����ӻ�����Ӧ���������һ���¶��µĴ����뱽�����______(��д���)��
a��pH b���е� c�����볣�� d���ܽ��
(3)�ڱ�ʵ��ĵζ������У����в�����ʹʵ����ƫ�����________(��д���)��
a����ʽ�ζ����ڵζ�ʱδ�ñ�NaOH��Һ��ϴ
b����ʽ�ζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ
c����ƿ�м������״���Һ���ټ�����ˮ
d����ƿ�ڵζ�ʱ����ҡ����������Һ�彦��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������OH�����Ӿ�����ͬ������������ͬ�ĵ���������������Ϊ�� ��
A.F��
B.Mg2+
C.NH4+
D.CH4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com