
【题目】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子层结构;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_______________。(填元素符号),其中C原子的核外电子排布式为__________________________。
(2)单质A有两种同素异形体,其中沸点高的是___________(填分子式),原因是___________________。A 和B的氧化物所属的晶体类型分别为__________和___________。
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为______________,中心原子的杂化轨道类型为______________________。
(4)化合物D2A的立体构型为_____________,中心原子的价层电子对数为_______________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为____________________________________。
(5)A 和B能够形成化合物F,其晶胞结构如图所示,F的化学式为_____________;晶胞中A原子的配位数为____________________。
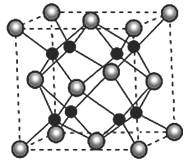
【答案】 O 1s22s22p63s23p3(或[Ne] 3s23p3) O3 O3相对分子质量较大,范德华力较大 分子晶体 离子晶体 三角锥形 sp3杂化 V形 4 2Cl2+2Na2CO3+H2O===Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3===Cl2O+CO2+2NaCl) Na2O 8
【解析】已知C核外电子总数是最外层电子数的3倍,可知C的原子序数为15,为![]() ;C和D同周期,D元素最外层有一个未成对电子,D是
;C和D同周期,D元素最外层有一个未成对电子,D是![]() ;A、B原子序数小于C且A的化和价为-2,B为+1,可知A为
;A、B原子序数小于C且A的化和价为-2,B为+1,可知A为![]() ,B为
,B为![]() 。故A为
。故A为![]() ,B为
,B为![]() 。C为
。C为![]() ,D为
,D为![]() 。
。
(1)四种元素中电负性最大的为氧元素,其中磷原子的核外电子排布式为![]() 。
。
(2)A的两种同素异形体为氧气![]() 和臭氧
和臭氧![]() ,其中臭氧的沸点更高,因为二者都是分子晶体,其中臭氧的相对分子质量更大,范德华力更大,因此沸点更高;A的氢化物为水,是分子晶体;B的氢化物为氢化钠,是离子晶体。
,其中臭氧的沸点更高,因为二者都是分子晶体,其中臭氧的相对分子质量更大,范德华力更大,因此沸点更高;A的氢化物为水,是分子晶体;B的氢化物为氢化钠,是离子晶体。
(3)C和D反应生成E的化学式为![]() ,其中磷原子与三个氯原子结合后还有一对孤对电子,故该物质的立体构型为三角锥形,磷的杂化方式为
,其中磷原子与三个氯原子结合后还有一对孤对电子,故该物质的立体构型为三角锥形,磷的杂化方式为![]() 杂化。
杂化。
(4)![]() 的立体构型与水类似,为V形,中心原子氧原子和两个氯原子结合后还有两对孤对电子,和每个氯原子中间又各自形成一个
的立体构型与水类似,为V形,中心原子氧原子和两个氯原子结合后还有两对孤对电子,和每个氯原子中间又各自形成一个![]() 键,故价层电子对数为4;氯气与水和碳酸钠反应制取一氧化二氯的方程式为:
键,故价层电子对数为4;氯气与水和碳酸钠反应制取一氧化二氯的方程式为:![]() 。
。
(5)A和B中,钠离子的半径小于氧离子,故图中大的离子是氧,小的离子是钠,该晶胞中共含有8个钠离子,4个氧离子,最简整数比为![]() ,故该化合物的化学式为
,故该化合物的化学式为![]() ,其中距离每个氧离子最近的钠离子有8个,故其配位数为8
,其中距离每个氧离子最近的钠离子有8个,故其配位数为8


科目:高中化学 来源: 题型:
【题目】已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式_____________________________________ 。
(2)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH______________ (填“大”、“小”或“相等”) 。
(3)常温下将0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为_____________________________________ 。
(4)往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为________________。
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入c mol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组按如下流程,进行海带中碘含量的测定和碘的制取等实验。
I. 碘含量的测定

(1)步骤①是将海带置于__________中(填仪器名称)进行灼烧。
(2)步骤④是将溶液转移至________________(填定容仪器的名称)。
(3)取20.00mL 上述海带浸取原液,加稀H2SO4和足量KIO3,使![]() 和
和![]() 完全反应(
完全反应(![]() )。再以淀粉为指示剂,用
)。再以淀粉为指示剂,用![]() mol/L的Na2S2O3溶液滴定(
mol/L的Na2S2O3溶液滴定(![]() ),当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。
),当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。
(4)判断用Na2S2O3溶液滴定恰好完全反应的现象是__________________________。
(5)计算该干海带中碘的质量分数_________________。
II. 碘的制取
另制海带浸取原液,按如下方案制取碘:
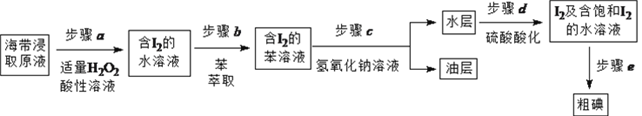
(1)补全步骤![]() 的反应方程式,配平并标出电子转移的数目和方向。
的反应方程式,配平并标出电子转移的数目和方向。
![]() ,_______________
,_______________
(2)步骤![]() 加入足量NaOH溶液、振荡、静置后,油层在_____(填“上”或“下”)层,呈____色。
加入足量NaOH溶液、振荡、静置后,油层在_____(填“上”或“下”)层,呈____色。
(3)步骤![]() 的操作是_______________。
的操作是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用。某型甲醇燃料电池的总反应式2CH40+302=2C02↑+4H20,下图是该燃料电池的示意图。
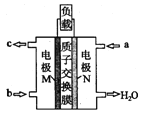
下列说法错误的是
A.燃料电池将化学能转化为电能
B.a是甲醇,b是氧气
C.质子从M电极区穿过交换膜移向N电极区
D.负极反应:CH40-6e-+H20=C02↑+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在潮湿空气中易水解氧化;见光则分解,变成褐色;CuCl难溶于醇和水,可溶于氯离子浓度较大的体系。下图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)
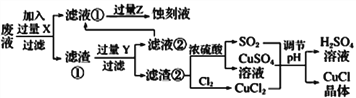
根据以上信息回答下列问题:
(1)写出生产过程中所用物质的名称:____________,________________。
(2)写出产生CuCl的化学方程式:________________________________。
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由________________________________________________。实际生产中SO2要适当过量,原因可能是___(答一点即可).
(4)得到CuC1晶体后,还需要经过水洗、乙醇洗涤两步操作。用乙醇洗涤的作用是________________。
(5)实验探究pH对CuCl产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为_________,当pH较大时CuCl产率变低原因是________________。
(6)氯化亚铜的定量分析:
①称取样品0.25g和过量的FeCl3溶液于250mL锥形瓶中,充分溶解。
②用0.10molL-1硫酸铈标准溶液滴定。已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 | /tr>
则样品中CuCl的纯度为_______________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 0.1 mol·L-1氨水中,c(OH-)=c(NH4+)
B. 10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C. 在0.1 mol·L-1的(NH4)2SO4溶液中,c(SO42-)>c(NH4+)>c(H+)>c(OH-)
D. 0.1 mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,可充电的钠——二氧化碳电池是当今新能源领域的热点,具有优异的性能。下列说法正确的是( )
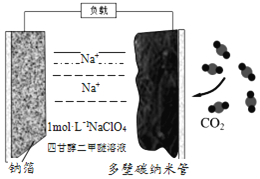
A. 钠金属片为正极
B. 该电池中的电解质为NaClO4,工作时ClO4-向碳纳米管电极移动
C. 总反应为:![]()
D. 放电时,每消耗3molCO2,转移12mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com