
【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。
完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加。
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。
(3)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”“小于”或“等于”)
等浓度广东草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
a.[H+]>[HC2O4-]>[HCO3-]>span>[CO32-] b.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c.[H+]>[HC2O4-]>[C2O42-]>[CO32-] d.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-![]() H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
________________________________
【答案】(1)
v正 | v逆 | 平衡常数K | 转化率α |
增大 | 增大 | 减小 | 减小 |
(2)![]() (3)大于;草酸;ac (4)当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变。(合理即给分)
(3)大于;草酸;ac (4)当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变。(合理即给分)
【解析】
试题(1)H2的体积分数随温度的升高而增加,这说明升高温度平衡逆反应方向进行,即正反应是放热反应。升高温度正逆反应速率均增大,平衡逆反应方向进行,平衡常数减小,反应物的转化率减小。
(2)相同温度时平衡常数不变,则a、b、c、d与m、n、x、y之间的关系式为![]() 。
。
(3)根据电离常数可知草酸的酸性强于碳酸,则碳酸钠的水解程度大于草酸钠,所以0.1 mol/L Na2CO3溶液的pH大于0.1 mol/L Na2C2O4溶液的pH。草酸的酸性强于碳酸,则等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是草酸。A.草酸的二级电离常数均大于碳酸的,所以草酸的电离程度大于,因此溶液中[H+]>[HC2O4-]>[C2O42-]>[HCO3-]>[CO32-],a正确;B.根据a中分析可知b错误;c.根据a中分析可知c正确;d.根据a中分析可知d错误,答案选ac。
(4)根据平衡可知当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 常温常压下,11.2L二氧化硫所含的氧原子数等于NA
B. 0.5molH2O所含的电子数为9NA
C. 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA
D. 300mL2mol·L-1蔗糖溶液中所含分子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器发生下列反应:aA(g)![]() cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将容器体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. 平衡向正反应方向移动
B. a<c+d
C. D的体积分数增大
D. A的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空,已知NA为阿伏伽德罗常数的数值。
(1)标准状况下,2.24L Cl2的质量为____;有__个氯原子。
(2)含0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是____。
(3)阻燃剂碱式碳酸铝镁中OH-与CO32﹣质量之比为51:300,则这两种离子的物质的量之比为____。
(4)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是____。
(5)标准状况下,3.4g NH3的体积为___;它与标准状况下____L H2S含有相同数目的氢原子。
(6)10.8g R2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为___;R元素名称是___。
(7)将10mL 1.00mol/L Na2CO3溶液与10mL 1.00mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为___,混和溶液中Cl-的物质的量___(忽略混合前后溶液体积的变化)。
(8)a个X原子的总质量为b g,则X的相对原子质量可以表示为____
(9)已知CO、CO2混合气体的质量共11.6g,在标准状况下的体积为6.72L,则混合气体中CO的质量为___;CO2在相同状况下的体积为___。
(10)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。则该混合气体中CH4和O2的体积比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。下列说法错误的是

A. a、b两处的混合气体成分含量相同,温度不同
B. c、d两处的混合气体成分含量相同,温度不同
C. 热交换器的作用是预热待反应的气体,冷却反应后的气体
D. c处气体经热交换后再次催化氧化的目的是提高SO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W有如图所示的转化关系,已知焓变:ΔH=ΔH1+ΔH2,则X、Y不可能是

A. C、CO B. AlCl3、Al(OH)3 C. Fe、Fe(NO3)2 D. Na2O、Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能说明苯酚是弱酸的实验事实是
A. 苯酚遇FeCl3溶液呈紫色 B. 苯酚能与NaOH溶液反应
C. 常温下苯酚在水中的溶解度不大 D. 将CO2通入苯酚钠溶液出现浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度和体积固定的密闭容器中,可逆反应H2(g)+I2(g) ![]() 2HI(g) (无色)达平衡状态,该状态下,说法不正确的是( )
2HI(g) (无色)达平衡状态,该状态下,说法不正确的是( )
A. 可逆反应停止 B. I2浓度不再变化
C. HI浓度不再变化 D. 混合气体颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到目的的是( )
A. 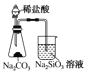 证明非金属性Cl>C>Si B.
证明非金属性Cl>C>Si B.  “喷泉”实验
“喷泉”实验
C.  制取并收集干燥纯净的NH3 D.
制取并收集干燥纯净的NH3 D. 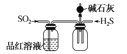 探究SO2的还原性和漂白性
探究SO2的还原性和漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com