
����Ŀ����Ҫ����գ���֪NAΪ����٤����������ֵ��
��1����״���£�2.24L Cl2������Ϊ____����__����ԭ�ӡ�
��2����0.4mol Al3����Al2(SO4)3��������SO42�������ʵ�����____��
��3����ȼ����ʽ̼����þ��OH-��CO32������֮��Ϊ51��300�������������ӵ����ʵ���֮��Ϊ____��
��4��������ͬ��H2��NH3��SO2��O3���������У����з�����Ŀ���ٵ���____��
��5����״���£�3.4g NH3�����Ϊ___�������״����____L H2S������ͬ��Ŀ����ԭ�ӡ�
��6��10.8g R2O5����ԭ�ӵ���ĿΪ3.01��1023����Ԫ��R�����ԭ������Ϊ___��RԪ��������___��
��7����10mL 1.00mol/L Na2CO3��Һ��10mL 1.00mol/L CaCl2��Һ���ͣ�������Һ��Na+�����ʵ���Ũ��Ϊ___�������Һ��Cl-�����ʵ���___�����Ի��ǰ����Һ����ı仯����
��8��a��Xԭ�ӵ�������Ϊb g����X�����ԭ���������Ա�ʾΪ____
��9����֪CO��CO2��������������11.6g���ڱ�״���µ����Ϊ6.72L������������CO������Ϊ___��CO2����ͬ״���µ����Ϊ___��
��10����CH4��O2����ɵĻ�����壬�ڱ���µ��ܶ���H2��14.5������û��������CH4��O2�������Ϊ___��
���𰸡�7.1g 0.2NA��1.204��1023 0.6mol 3:5 SO2 4.48L 6.72 14 �� 1mol/L 0.02mol ![]() NA��6.02��1023
NA��6.02��1023![]() 2.8g 4.48L 3:13
2.8g 4.48L 3:13
��������
��1���ȼ����״���£�2.24L Cl2�����ʵ������ټ�����������������ԭ�Ӹ�����
��2���ɻ�ѧʽ��������������ʵ�����
��3�����������ӵ������Ƚ��Ħ�����������������ӵ����ʵ���֮�ȣ�
��4����n=![]() ��֪��������ͬ�IJ�ͬ���壬�����Ħ������Խ�����ʵ���ԽС��������ԽС��
��֪��������ͬ�IJ�ͬ���壬�����Ħ������Խ�����ʵ���ԽС��������ԽС��
��5���ȼ����״���£�3.4g NH3�����ʵ������ټ������������������ԭ�ӵ����ʵ��������������ԭ�ӵ����ʵ�����������������
��6����R2O5��������������ԭ�Ӹ���������ϵʽ����R�����ԭ��������
��7����10mL 1.00 mol/L Na2CO3��Һ��10mL 1.00mol/L CaCl2��Һ���ͷ�����Ӧ������̼��Ƴ������Ȼ��ƣ���Ӧ������Na+��Cl-�����ʵ������䣻
��8���ȼ���a��Xԭ�ӵ����ʵ�������������������X��Ħ��������
��9�����ݻ������������������������ϵʽ���һ����̼�Ͷ�����̼�����ʵ������ڷֱ����һ����̼�����Ͷ�����̼�����
��10���ȼ����������ƽ����Է��������������ݹ�ʽ������������������ȡ�
��1����״���£�2.24L Cl2�����ʵ���Ϊ![]() =0.1mol������Ϊ0.1mol��71g/mol=7.1g��Cl2Ϊ˫ԭ�ӷ��ӣ����е���ԭ�Ӹ���Ϊ0.2NA��1.204��1023���ʴ�Ϊ��7.1g��0.2NA��1.204��1023��
=0.1mol������Ϊ0.1mol��71g/mol=7.1g��Cl2Ϊ˫ԭ�ӷ��ӣ����е���ԭ�Ӹ���Ϊ0.2NA��1.204��1023���ʴ�Ϊ��7.1g��0.2NA��1.204��1023��
��2���ɻ�ѧʽ��֪����0.4mol Al3����Al2(SO4)3��������SO42�������ʵ�����0.4mol��![]() =0.6mol���ʴ�Ϊ��0.6mol��
=0.6mol���ʴ�Ϊ��0.6mol��
��3����ȼ����ʽ̼����þ��OH-��CO32������֮��Ϊ51��300�������������ӵ����ʵ���֮��Ϊ![]() ��
��![]() =3:5���ʴ�Ϊ��3:5��
=3:5���ʴ�Ϊ��3:5��
��4����n=![]() ��֪��������ͬ�IJ�ͬ���壬�����Ħ������Խ�����ʵ���ԽС��������ԽС��H2��NH3��SO2��O3����������SO2��Ħ�����������SO2�����ʵ�����С����������С���ʴ�Ϊ��SO2��
��֪��������ͬ�IJ�ͬ���壬�����Ħ������Խ�����ʵ���ԽС��������ԽС��H2��NH3��SO2��O3����������SO2��Ħ�����������SO2�����ʵ�����С����������С���ʴ�Ϊ��SO2��
��5����״���£�3.4g NH3�����ʵ���Ϊ![]() =0.2mol�������Ϊ0.2mol��22.4L/mol=4.48L��������ԭ�ӵ����ʵ���Ϊ0.2mol��3=0.6mol��������ԭ�ӵ����ʵ���Ϊ0.6mol��H2S�����ʵ���Ϊ
=0.2mol�������Ϊ0.2mol��22.4L/mol=4.48L��������ԭ�ӵ����ʵ���Ϊ0.2mol��3=0.6mol��������ԭ�ӵ����ʵ���Ϊ0.6mol��H2S�����ʵ���Ϊ![]() =0.3mol����״���£�0.3mol H2S�����Ϊ0.3mol��22.4L/mol=6.72L���ʴ�Ϊ��4.48L��6.72��
=0.3mol����״���£�0.3mol H2S�����Ϊ0.3mol��22.4L/mol=6.72L���ʴ�Ϊ��4.48L��6.72��
��6����Ԫ��R�����ԭ������ΪM��10.8g R2O5�����ʵ���Ϊ![]() =
=![]() mol��������ԭ�ӵ���ĿΪ
mol��������ԭ�ӵ���ĿΪ![]() mol��6.02��1023��5=3.01��1023�����M=14����Ԫ��ΪNԪ�أ��ʴ�Ϊ��14��N��
mol��6.02��1023��5=3.01��1023�����M=14����Ԫ��ΪNԪ�أ��ʴ�Ϊ��14��N��
��7����10mL 1.00mol/L Na2CO3��Һ��10mL 1.00mol/L CaCl2��Һ���ͷ�����Ӧ������̼��Ƴ������Ȼ��ƣ���Ӧ������Na+��Cl-�����ʵ������䣬10mL 1.00mol/L Na2CO3��Һ��Na+�����ʵ���Ϊ0.01L��1.00 mol/L��2=0.02mol��������Һ��Na+�����ʵ���Ũ��Ϊ![]() =1.00mol/L��10mL 1.00mol/L CaCl2��Һ��Cl-�����ʵ���Ϊ0.01L��1.00 mol/L��2=0.02mol��������Һ��Cl-�����ʵ���0.02mol���ʴ�Ϊ��1mol/L��0.02mol��
=1.00mol/L��10mL 1.00mol/L CaCl2��Һ��Cl-�����ʵ���Ϊ0.01L��1.00 mol/L��2=0.02mol��������Һ��Cl-�����ʵ���0.02mol���ʴ�Ϊ��1mol/L��0.02mol��
��8��a��Xԭ�ӵ����ʵ���Ϊ![]() mol��X��Ħ������Ϊ
mol��X��Ħ������Ϊ![]() =
=![]() g/mol����X�����ԭ������
g/mol����X�����ԭ������![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��
��9����CO��CO2���������COΪx mol��CO2Ϊy mol��������ɵ�28x+44y=11.6�٣�x+y=![]() =0.3mol�ڣ���٢ڿɵ�x=0.1��y=0.2����0.1mol CO������Ϊ0.1mol��28g/mol=2.8g��0.2mol CO2�ڱ�״���µ����Ϊ0.2mol��22.4L/mol=4.48L���ʴ�Ϊ��2.8g��4.48L��
=0.3mol�ڣ���٢ڿɵ�x=0.1��y=0.2����0.1mol CO������Ϊ0.1mol��28g/mol=2.8g��0.2mol CO2�ڱ�״���µ����Ϊ0.2mol��22.4L/mol=4.48L���ʴ�Ϊ��2.8g��4.48L��
��10���������֪��CH4��O2����ɵĻ������ƽ����Է�������Ϊ2��14.5=29�����������м�������ʵ���Ϊx�����������ʵ���Ϊy������![]() =29�����x��y=3:13���ʴ�Ϊ��3:13��
=29�����x��y=3:13���ʴ�Ϊ��3:13��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����CH3OH(g)��![]() O2(g)=CO2(g)��2H2O(g) ��H����a kJ��mol
O2(g)=CO2(g)��2H2O(g) ��H����a kJ��mol
��CO(g)��![]() O2(g)=CO2(g) ��H����b kJ��mol
O2(g)=CO2(g) ��H����b kJ��mol
��H2(g)��![]() O2(g)=H2O(g) ��H����c kJ��mol
O2(g)=H2O(g) ��H����c kJ��mol
��H2(g)��![]() O2(g)=H2O(l) ��H����d kJ��mol
O2(g)=H2O(l) ��H����d kJ��mol
������������ȷ����
A. �������Ȼ�ѧ����ʽ��֪d��c
B. H2��ȼ����Ϊd kJ��mol
C. CH3OH(g)=CO(g)��2H2(g) ��H��(b��2c��a)kJ��mol
D. ��CO��H2�����ʵ���֮��Ϊ1��2ʱ������ȫȼ������CO2��H2O(l)ʱ���ų�Q kJ��������������CO�����ʵ���Ϊ![]() mol
mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������,��3 mol A��1 mol B�������������ݻ�Ϊ2 L���ܱ�������,������Ӧ:3A(g)+B(g)![]() xC(g)+2D(s)��2 minĩ�÷�Ӧ�ﵽƽ��,����0.8 mol D,�����C��Ũ��Ϊ0.2 mol/L�������ж���ȷ����(����)
xC(g)+2D(s)��2 minĩ�÷�Ӧ�ﵽƽ��,����0.8 mol D,�����C��Ũ��Ϊ0.2 mol/L�������ж���ȷ����(����)
A. �������´˷�Ӧ��ƽ�ⳣ��ԼΪ0.91
B. 2 min��A��ƽ����Ӧ����Ϊ0.3 mol/(L��s)
C. B��ת����Ϊ60%
D. ���������ܶȲ��ٸı�ʱ,�÷�Ӧ��һ���ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl3��Һ��KSCN��Һ���ʱ��������ƽ�⣺Fe3+(aq)+SCN-( aq) ![]() Fe(SCN)2��(aq) ��֪ijһ�����£���Ӧ�ﵽƽ��ʱ��Fe(SCN)2�������ʵ���Ũ�����¶ȵĹ�ϵ��ͼ��ʾ������˵����ȷ����
Fe(SCN)2��(aq) ��֪ijһ�����£���Ӧ�ﵽƽ��ʱ��Fe(SCN)2�������ʵ���Ũ�����¶ȵĹ�ϵ��ͼ��ʾ������˵����ȷ����

A���÷�ӦΪ���ȷ�Ӧ
B��T1��T2ʱ��Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2����K1>K2
C����Ӧ����D��ʱ��һ����v������v��
D��A���c(Fe3��)��B���c(Fe3��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��һ�ܱ���������Ħ�����ɻ�����������a��b�ֳɼס������ҡ���״���£��������г���0.6mol HCl�������г���NH3��H2�Ļ�����壬��ֹʱ����λ����ͼ����֪�ס������������������֮��Ϊ10.9g��

��1����������������ʵ���Ϊ____mol
��2�����������������Ϊ____g
��3��������NH3��H2��ƽ����Է�������Ϊ___��
��4������������֪��HCl+NH3=NH4Cl��NH4Cl�������ǹ��壩���������aȥ������HCl��NH3��ȫ��Ӧ����b�������ڿ̶���___�����������֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ſ�ѧ�����ķ�չ�ͻ���Ҫ��IJ�����ߣ�CO2�IJ������ü�����Ϊ�о����ص㡣
���������գ�
��1��Ŀǰ���ʿռ�վ����CO2��һ����Ҫ�����ǽ�CO2��ԭ�����漰�ķ�Ӧ����ʽΪ��
CO2��g��+4H2��g��![]() CH4��g��+2H2O��g��
CH4��g��+2H2O��g��
��֪H2������������¶ȵ����߶����ӡ�
���¶ȴ�300������400�������´ﵽƽ�⣬�ж����б����и��������ı仯����ѡ����������������С��������������
v�� | v�� | ƽ�ⳣ��K | ת������ |
��2����ͬ�¶�ʱ��������Ӧ�ڲ�ͬ��ʼŨ���·ֱ�ﵽƽ�⣬�����ʵ�ƽ��Ũ�����±���
[CO2]/mol��L-1 | [H2]/mol��L-1 | [CH4]/mol��L-1 | [H2O]/mol��L-1 | |
ƽ���� | a | b | c | d |
ƽ���� | m | n | x | y |
a��b��c��d��m��n��x��y֮��Ĺ�ϵʽΪ_________��
��3��̼�H2CO3��Ki1=4.3��10-7��Ki2=5.6��10-11
���H2C2O4��Ki1=5.9��10-2��Ki2=6.4��10-5
0.1 mol/L Na2CO3��Һ��pH____________0.1 mol/L Na2C2O4��Һ��pH����ѡ������������С����������������
��Ũ�ȹ㶫������Һ��̼����Һ�У�������Ũ�Ƚϴ����___________��
������Ũ�ȵIJ�����Һ��̼����Һ�������ϣ���Һ�и�������Ũ�ȴ�С��˳����ȷ����_____����ѡ���ţ�
a��[H+]��[HC2O4-]��[HCO3-]��span>[CO32-] b��[HCO3-]��[HC2O4-]��[C2O42-]��[CO32-]
c��[H+]��[HC2O4-]��[C2O42-]��[CO32-] d��[H2CO3] ��[HCO3-]��[HC2O4-]��[CO32-]
��4������ѪҺ�е�̼���̼�����δ���ƽ�⣺H++ HCO3-![]() H2CO3�������������Ի�������ʽ���ѪҺ��ʱ��ѪҺ��pH�仯������ƽ���ƶ�ԭ��������������
H2CO3�������������Ի�������ʽ���ѪҺ��ʱ��ѪҺ��pH�仯������ƽ���ƶ�ԭ��������������
________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ҫ��ش����⣺


��1�����Ȼ�����Һ�еõ��Ȼ��ع��壬ѡ��װ��________(�����װ�õ���ĸ����ͬ)
��2������ˮ������з����ֲ���ͣ�ѡ��װ��________���÷��뷽��������Ϊ________��
��3��װ��A�Тٵ�������________��ˮ�ķ����Ǵ�________�ڽ�ˮ_______�ڳ�ˮ��
��4��װ��B�ڷ�Һʱ�������²�Һ���________���ϲ�Һ���________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽�����������п��ϡ���ᷴӦ���ʵ�Ӱ�죬������·���:
��� | ��п�� | 0. 2 mol��L-1������Һ | �¶� | ����ͭ���� |
�� | 2. 0 g | 200. 0 mL | 25 �� | 0 |
�� | 2. 0 g | 200. 0 mL | 35 �� | 0 |
�� | 2. 0 g | 200. 0 mL | 35 �� | 0. 2 g |
������������ȷ����
A. ��͢�ʵ��̽���¶ȶԷ�Ӧ���ʵ�Ӱ��
B. ��͢�ʵ��̽��ԭ��ضԷ�Ӧ���ʵ�Ӱ��
C. ��Ӧ���ʢ�>��>��
D. ʵ�������������ı仯ͼ����ͼ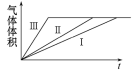
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com