
【题目】在一定温度和体积固定的密闭容器中,可逆反应H2(g)+I2(g) ![]() 2HI(g) (无色)达平衡状态,该状态下,说法不正确的是( )
2HI(g) (无色)达平衡状态,该状态下,说法不正确的是( )
A. 可逆反应停止 B. I2浓度不再变化
C. HI浓度不再变化 D. 混合气体颜色不再变化
【答案】A
【解析】
A.可逆反应达到平衡状态时正逆反应速率相等但不等于0,反应也没有停止,是一个动态平衡,故A错误;
B. 在一定条件下,反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,平衡时I2浓度不再发生变化,说明达到平衡状态,故B正确;
C.在一定条件下,反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,平衡时HI浓度不再发生变化,说明达到平衡状态,故C正确;
D.在反应混合物中I2(g)是紫色气体,其它都是无色气体。如果反应未达到平衡,则I2(g)的浓度就要发生变化,混合气体的颜色就要改变。若反应达到平衡,则气体的颜色就不会发生变化。因此混合气体的颜色不再改变能作为判断反应达到平衡的标志,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) △H=-a kJ/mol
O2(g)=CO2(g)+2H2O(g) △H=-a kJ/mol
②CO(g)+![]() O2(g)=CO2(g) △H=-b kJ/mol
O2(g)=CO2(g) △H=-b kJ/mol
③H2(g)+![]() O2(g)=H2O(g) △H=-c kJ/mol
O2(g)=H2O(g) △H=-c kJ/mol
④H2(g)+![]() O2(g)=H2O(l) △H=-d kJ/mol
O2(g)=H2O(l) △H=-d kJ/mol
下列叙述不正确的是
A. 由上述热化学方程式可知d>c
B. H2的燃烧热为d kJ/mol
C. CH3OH(g)=CO(g)+2H2(g) △H=(b+2c-a)kJ/mol
D. 当CO和H2的物质的量之比为1∶2时,其完全燃烧生成CO2和H2O(l)时,放出Q kJ热量,则混合气中CO的物质的量为![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。
完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加。
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。
(3)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”“小于”或“等于”)
等浓度广东草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
a.[H+]>[HC2O4-]>[HCO3-]>span>[CO32-] b.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c.[H+]>[HC2O4-]>[C2O42-]>[CO32-] d.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-![]() H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据要求回答问题:


(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置的字母,下同)
(2)从油水混合物中分离出植物油,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,水的方向是从________口进水_______口出水。
(4)装置B在分液时打开活塞后,下层液体从________,上层液体从________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. 14C中含有14个中子B. 1H、2H、3H是同一种核素
C. H2O与D2O互称同位素D. C60、金刚石、石墨均为碳的同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2 II
CO(g)+H2O(g) △H2 II
某实验室控制CO2和H2初始投料比为1︰2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJmol-1和-285.8kJmol-1。
②H2O(l)=H2O(g) △H3=+44.0kJmol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=______;反应II的△H2=______kJmol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有__________。
A.使用催化剂Cat.1 B.使用催化剂Cat.2
C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大 CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___________________________。
(4)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图_________。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在______极,该电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究外界条件对锌与稀硫酸反应速率的影响,设计如下方案:
编号 | 纯锌粉 | 0. 2 mol·L-1硫酸溶液 | 温度 | 硫酸铜固体 |
Ⅰ | 2. 0 g | 200. 0 mL | 25 ℃ | 0 |
Ⅱ | 2. 0 g | 200. 0 mL | 35 ℃ | 0 |
Ⅲ | 2. 0 g | 200. 0 mL | 35 ℃ | 0. 2 g |
下列叙述不正确的是
A. Ⅰ和Ⅱ实验探究温度对反应速率的影响
B. Ⅱ和Ⅲ实验探究原电池对反应速率的影响
C. 反应速率Ⅲ>Ⅱ>Ⅰ
D. 实验Ⅰ、Ⅱ、Ⅲ的变化图象如图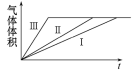
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各图曲线表征的信息。得出的结论正确的是
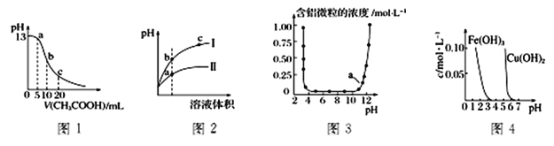
A. 图1表示常温下向体积为10mL0.1 molL-1NaOH溶液中逐滴加入0.1 molL-1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B. 图2表示用水稀释pH相同的盐酸和NH4C1溶液时。溶液的pH变化曲线,其中Ⅰ表示盐酸,Ⅱ表示NH4C1溶液,且溶液导电性:b>c>a
C. 图3表示的是Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
D. 由图4得出若除去Fe2(SO4)3溶液中的Cu2+,可采用向溶液中加入适量Fe2O3,调节溶液的pH 至4左右
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com