
【题目】一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是
A.该反应的正方应为放热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
【答案】AD
【解析】试题分析:A、容器I与容器Ⅲ相比甲醇的起始物质的量相等,但温度不同,温度较低时生成物的物质的量多,这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应,A正确;B、反应前后体积不变,因此容器Ⅱ与容器I相比平衡等效,因此达到平衡时,容器I中的CH3OH体积分数和容器Ⅱ中的相等, B不正确;C、容器I中温度高,反应速率快,因此容器I中反应达到平衡所需时间比容器Ⅲ中的少,C不正确;D、根据容器I表中数据可知,平衡时生成物的浓度均是0.080mol/L,则根据反应的化学方程式可知消耗甲醇的浓度是0.16mol/L,所以平衡时甲醇的浓度是0.04mol/L,所以该温度下的平衡常数K=![]() =4。若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则此时
=4。若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则此时![]() =1.5<4,所以反应将向正反应方向进行,D正确,答案选AD。
=1.5<4,所以反应将向正反应方向进行,D正确,答案选AD。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. 14C中含有14个中子B. 1H、2H、3H是同一种核素
C. H2O与D2O互称同位素D. C60、金刚石、石墨均为碳的同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在外加电流的阴极保护法中,须将被保护的钢铁设备与直流电源的负极相连
B. 反应H2S(g)+ZnO(s)===H2O(g)+ZnS(s)在一定条件下可自发进行,且ΔS<0,则ΔH>0
C. 常温常压,氢氧燃料电池工作消耗2.24 L O2时,转移电子的数目为0.4×6.02×1023
D. 常温下,Ksp[Cu(OH)2]=2.6×10-19,pH=10的含Cu2+的溶液中,c(Cu2+)≥2.6×10-11mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取2.3g金属钠投入到100g水中,所得溶液的密度为1.022g/cm3。
(1)写出钠与水反应的化学方程式并标出电子转移的方向和数目;_________。
(2)该反应的还原剂是____________,还原产物是______________。
(3)求反应后产生的气体在标准状况下的体积和所得溶液的物质的量浓度。______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气是制备含氮化合物的一种重要物质。两个常见的固氮反应[①N2(g)+3H2(g)![]() 2NH3(g)和②N2(g)+O2(g)
2NH3(g)和②N2(g)+O2(g)![]() 2NO(g)],其平衡常数对数值(lg K)与温度的关系如下图。根据图中的数据判断下列说法正确的是
2NO(g)],其平衡常数对数值(lg K)与温度的关系如下图。根据图中的数据判断下列说法正确的是

A. 反应①和②均为放热反应
B. 升高温度,反应①的反应速率减小
C. 在常温下,利用反应①固氮和利用反应②固氮,反应程度相差很大
D. 在1 000 ℃时,反应①和反应②体系中N2的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各图曲线表征的信息。得出的结论正确的是
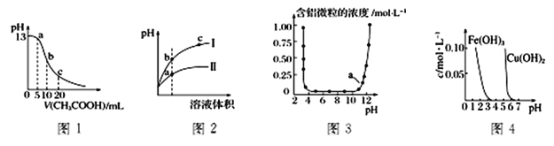
A. 图1表示常温下向体积为10mL0.1 molL-1NaOH溶液中逐滴加入0.1 molL-1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B. 图2表示用水稀释pH相同的盐酸和NH4C1溶液时。溶液的pH变化曲线,其中Ⅰ表示盐酸,Ⅱ表示NH4C1溶液,且溶液导电性:b>c>a
C. 图3表示的是Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
D. 由图4得出若除去Fe2(SO4)3溶液中的Cu2+,可采用向溶液中加入适量Fe2O3,调节溶液的pH 至4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图是金属镁和卤素单质(X2)反应的能量变化示意图。
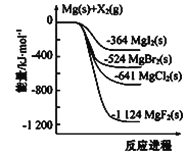
写出MgBr2(s)与Cl2(g)生成MgCl(s)和Br2(l)的热化学方程式______________________________。
(2)甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液。当电池中有2mol e-发生转移时,左右两侧溶液的质量之差为______g(假设反应物耗尽,忽略气体的溶解)。

(3)250mLK2SO4和CuSO4的混合溶液中c(SO42-)=0. 5mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12L气体(标准状况下)。假定电解后溶液体积仍为250mL,写出阴极电极反应式______________原混合溶液中c(K+)=__________________
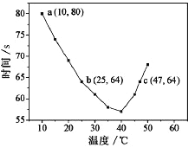
(4)NaHSO3溶液在不同温度下均可被过量![]() KIO3氧化。将浓度均为0.020mol/L
KIO3氧化。将浓度均为0.020mol/L![]() NaHSO3溶液(含少量淀粉)10ml
NaHSO3溶液(含少量淀粉)10ml![]() 、KIO3(过量)酸性溶液90.0ml混合,记录10—55℃间溶液变蓝时间,实验结果如图。据图分析,图中a点对应的
、KIO3(过量)酸性溶液90.0ml混合,记录10—55℃间溶液变蓝时间,实验结果如图。据图分析,图中a点对应的![]() NaHSO3反应速率为________________
NaHSO3反应速率为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电能是现代社会中应用最广泛的一种能源。下列与电有关的叙述中,正确的是( )
A.电能属于一次能源
B.锂离子电池属于一次性电池
C.火力发电将电能间接转化为热能
D.充电电池工作时发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2经催化加氢可合成乙烯:2CO2 (g) +6H2 (g) ![]() C2H4(g)+4H2O(g)。0.2 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述正确的是
C2H4(g)+4H2O(g)。0.2 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述正确的是

A. 该反应为吸热反应
B. 曲线a代表的是C2H4
C. N点和M点所处状态的c(H2O)相等
D. 其它条件不变,T1℃、0.1 MPa下反应达平衡时CO2的转化率比N点更大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com