
【题目】用如图所示的装置进行实验,反应一段时间后断开K,向烧杯中加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH.下列说法中不正确的是( ) 
A.铜棒为正极,其电极反应式为2H++2e﹣=H2↑
B.烧杯右侧碳棒为阴极,其电极表面有红色物质析出
C.反应中消耗锌的质量为6.5 g
D.导线中通过电子的物质的量为0.1 mol
【答案】D
【解析】解:A.Cu活泼性比Zn弱,作正极,正极上氢离子得电子生成氢气,则其电极反应式为2H++2e﹣═H2↑,故A正确;
B.烧杯右侧碳棒与原电池负极相连为阴极,阴极上阳离子得电子,即铜离子得电子析出铜单质,故B正确;
C.右侧烧杯中反应为:2CuSO4+2H2O ![]() 2Cu+O2 ↑+2H2SO4 , 加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH,则电解生成的铜为0.1mol,转移的电子为0.2mol,已知Zn﹣2e﹣═Zn2+ , 则溶解的Zn为0.1mol,即6.5g,故C正确;
2Cu+O2 ↑+2H2SO4 , 加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH,则电解生成的铜为0.1mol,转移的电子为0.2mol,已知Zn﹣2e﹣═Zn2+ , 则溶解的Zn为0.1mol,即6.5g,故C正确;
D.由题目可知,加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH,则电解生成的铜为0.1mol,转移的电子为0.2mol,故D错误.
故选D.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )
A.镁和铝的总质量为9 g
B.最初20 mL NaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.5 molL﹣1
D.生成的氢气在标准状况下的体积为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶质的质量分数和物质的量浓度的计算结果错误的是( )
A. 密度为0.91g/cm3的氨水,质量分数为25%。该氨水用等体积的水稀释后,所得溶液中溶质的质量分数等于12.5%
B. 有K2SO4和Al2(SO4)3的混合溶液,已如其中Al3+的物质的量浓度为0.4mol/L,SO42-的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为0.2mol/L
C. 将5mol/L的Mg(NO3)2溶液amL稀释至bmL,稀释后溶液中NO3-的物质的量浓变为![]() mol/L
mol/L
D. 将标准状况下,将VLA气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为ρg/cm3,则此溶液的物质的量浓度为![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中所示物质或概念间的从属关系符合如图的是
X | Y | Z | |
A | 钠元素 | 主族元素 | 短周期元素 |
B | 电解质 | 化合物 | 纯净物 |
C | 氢氧化铁 | 胶体 | 分散系 |
D | 置换反应 | 氧化还原反应 | 放热反应 |
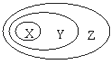
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子结构示意图是 .
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10 10C+P4O10═P4+10CO
每生成1mol P4时,就有mol电子发生转移.
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C6H8O6+I2═C6H6O6+2H++2I﹣ 2S2O32﹣+I2═S4O62﹣+2I﹣
在一定体积的某维生素C溶液中加入a molL﹣1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2 , 消耗b molL﹣1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是mol.
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3﹣+5SO32﹣+2H+═I2+5SO42﹣+H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
0.01molL﹣1 | 0.01molL﹣1 | H2O的体积 | 实验 | 溶液出现蓝色时所需时间/s | |
实验1 | 5 | V1 | 35 | 25 | |
实验2 | 5 | 5 | 40 | 25 | |
实验3 | 5 | 5 | V2 | 0 |
该实验的目的是;表中V2=mL
(5)Ⅱ、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl36H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是 .
(6)在某强酸性混合稀土溶液中加入H2O2 , 调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:Ce3++H2O2+H2O═Ce(OH)4↓+ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗定律成立的根本原因是在一定温度和压强下 ( )
A.气体体积的大小只随分子数量的多少而变化
B.不同气体分子的大小几乎相等
C.不同气体分子间的平均距离几乎相等
D.气体分子间的平均距离与分子本身的大小成正比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为 .
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com