
����Ŀ������ƽ�����ʢ��ǿ��ԭ��Һ̬�£�N2H4����ǿ������Һ̬˫��ˮ������0.4molҺ̬�º�0.8mol H2O2��Ϸ�Ӧ�����ɵ�����ˮ�������ų�256.7kJ���������൱��25�桢101kPa�²�õ���������
��1����Ӧ���Ȼ�ѧ����ʽΪ ��
��2������֪H2O��l��=H2O��g����H=+44kJ/mol����16gҺ̬����Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų���������kJ��
��3���˷�Ӧ���ڻ���ƽ������ͷŴ����ȺͿ��ٲ������������⣬����һ���ܴ���ŵ��� ��
���𰸡�
��1��N2H4��g��+2H2O2��l��=N2��g��+4H2O��g����H=��641.75kJ/mol
��2��408.815
��3�����ﲻ����ɻ�����Ⱦ
���������⣺��1����Ӧ����ʽΪ��N2H4+2H2O2=N2+4H2O��0.4molҺ̬�·ų�256.7KJ����������1molҺ̬�·ų�������Ϊ ![]() =641.75kJ��
=641.75kJ��
���Է�Ӧ���Ȼ�ѧ����ʽΪ��N2H4��l��+2H2O2��l��=N2��g��+4H2O��g����H=��641.75kJ/mol��
���Դ��ǣ�N2H4��g��+2H2O2��l��=N2��g��+4H2O��g����H=��641.75kJ/mol����2����N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=��641.75kJ/mol����H2O��l��=H2O��g����H=+44kJ/mol��
���ݸ�˹���ɢ٩��ڡ�4�õ�N2H4��l��+2H2O2��l���TN2��g��+4H2O��l����H=��817.75KJ/mol��
16gҺ̬�����ʵ���= ![]() =0.5mol��
=0.5mol��
����16gҺ̬����Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų���������408.875KJ�����Դ��ǣ�408.875����3���˷�Ӧ���ڻ���ƽ������ͷŴ����ȺͿ��ٲ������������⣬����һ���ܴ���ŵ��Dz���Ϊ������ˮ���ǿ����ɷֲ�����ɻ�����Ⱦ�����Դ��ǣ����ﲻ����ɻ�����Ⱦ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��װ�ý���ʵ�飬��Ӧһ��ʱ���Ͽ�K�����ձ��м���0.1mol CuO��CuSO4��Һǡ�ûָ�����Ӧǰ��Ũ�Ⱥ�pH������˵���в���ȷ���ǣ� �� 
A.ͭ��Ϊ��������缫��ӦʽΪ2H++2e��=H2��
B.�ձ��Ҳ�̼��Ϊ��������缫�����к�ɫ��������
C.��Ӧ������п������Ϊ6.5 g
D.������ͨ�����ӵ����ʵ���Ϊ0.1 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ù�����H2SO4��NaOH��NH3��H2O��NaCl����Һ�������в�������������ӣ�����Һ���������������� ( )
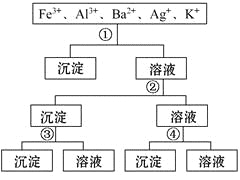
A. ��NaCl ��NaOH ��NH3��H2O ��H2SO4
B. ��H2SO4��NaOH ��NH3��H2O ��NaCl
C. ��H2SO4��NH3��H2O ��NaOH ��NaCl
D. ��NaCl ��NH3��H2O ��NaOH ��H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����500mLNaOH��Һ��Ͷ��10.8gAl������ǡ����ȫ��Ӧ����μӷ�Ӧ��NaOH�����ʵ���Ϊ________��ԭNaOH��Һ�����ʵ���Ũ��Ϊ________�����ɱ�״����H2�����Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����������ʵ����ƫ�ߵ��ǣ�������
A.�ⶨ����ͭ�����нᾧˮ������ʵ���У����������ȫʧȥ�ᾧˮ��ʢ��������������ʵ������������ȴ
B.��п��Ƥп�Ʋ��Ȳ���ʵ���У�����ƤС���ɡ�����ʱ��������γ���ǰ�����������
C.һ��Ũ�ȵ��������ƹ����У�����Ͳ��ȡ���������Ũ����ʱ�����ӹ۲�̶���
D.�ζ�ʵ��ʱ��װ����Һ�ĵζ���������ˮϴ����û���ô���Һ��ϴ2��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���ȫ�ֽ�����ij������2g����������1.8g���˻������ǣ� ��
A.1H218OB.1H216OC.2H216OD.2H218O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ�ɷ���Al2O3 �� ��SiO2��Fe2O3��MgO�����ʣ�����ȡ�����������ֹ���������ͼ��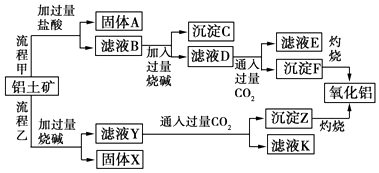
��ش��������⣺
��1��д�����̼����漰�����ӷ���ʽΪ���� ��
��2�������Ҽ����ռ��Al2O3������Ӧ�����ӷ���ʽΪ ��
��3������C����Ҫ�ɷ��� �� ��ȥ����C�IJ����� ��
��4����ҺD�����ʵ���Ҫ�ɷ������ѧʽ����д������ҺD��ͨ�����CO2������Ӧ�����ӷ���ʽ ��
��5���������У�ѡ��CO2���ữ�����ܲ������������CO2 ����ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���淶������ ��
A. 98gϡ��������������Ϊ1mol B. ����Ħ������Ϊ32g/mol
C. ij������Һ��H2SO4����������Ϊ60% D. ��״���£�1mol��������ԼΪ22.4L/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ƾ��壨 Na2MoO42H2O����һ����������ȴˮϵͳ�Ľ�����ʴ������ҵ�������⾫����Ҫ�ɷ��Dz�����ˮ��MoS2���Ʊ������Ƶ�����;����ͼ1��ʾ��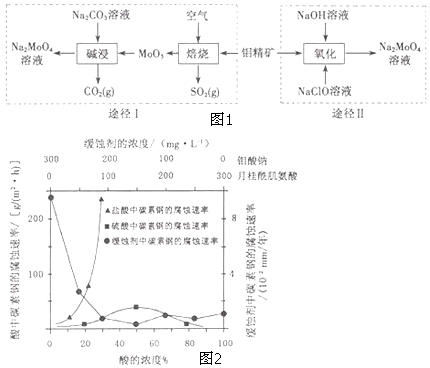
��1��NaClO�ĵ���ʽ�� ��
��2��Ϊ����߱���Ч�ʣ����������������Բ��õĴ�ʩ�� ��
��3��;��I���ʱ������Ӧ�����ӷ���ʽΪ ��
��4��;��������ʱ������Ӧ�����ӷ���ʽΪ ��
��5�������ƺ��¹���������Ļ��Һ����Ϊ̼�ظֵĻ�ʴ���������£�̼�ظ������ֲ�ͬ�����еĸ�ʴ����ʵ������ͼ2��
��Ҫʹ̼�ظֵĻ�ʴЧ�����ţ������ƺ��¹����������Ũ�ȱ�ӦΪ ��
�ڵ������Ũ�ȴ���90%ʱ����ʴ���ʼ���Ϊ�㣬ԭ���� ��
���Է����������������Ũ�ȵ�����̼�ظ��������и�ʴ���ʲ������Բ������Ҫԭ���� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com