
【题目】下列实验操作会引起实验结果偏高的是( )
A.测定硫酸铜晶体中结晶水含量的实验中,晶体加热完全失去结晶水后,将盛试样的坩埚放在实验桌上自行冷却
B.镀锌铁皮锌镀层厚度测量实验中,将铁皮小火烘干、称量时,最后两次称量前后质量不相等
C.一定浓度的盐酸配制过程中,用量筒量取计算所需的浓盐酸时,仰视观察刻度线
D.滴定实验时,装待测液的滴定管用蒸馏水洗净后,没有用待测液润洗2~3次
【答案】C
【解析】A.在硫酸铜晶体(CuSO4n H2O)结晶水含量测定中,加热前后质量的减少量即是失去结晶水的质量,加热后放在空气中冷却,会吸收空气中的水重新形成晶体,反应前后质量差减小,结果偏小,故A不符合题意;
B.镀锌铁皮锌镀层厚度测量实验中,将铁皮小火烘干、称量时,最后两次称量前后质量不相等,说明铁粉已被氧化,导致质量差偏小,根据测量原理厚度d= ![]() =
= ![]() 可知,测定结果偏低,故B不符合题意;
可知,测定结果偏低,故B不符合题意;
C.一定浓度的盐酸配制过程中,用量筒量取计算所需的浓盐酸时,仰视观察刻度线,会导致量取液体的体积偏大,所配溶液浓度偏的,故C符合题意;
D.滴定实验时,装待测液的滴定管用蒸馏水洗净后,没有用待测液润洗2~3,待测液的浓度偏小,导致一定体积待测液的物质的量偏小,最终V(标)偏小,根据c(待测)= ![]() 分析,可知C(待测)偏小,故D不符合题意;
分析,可知C(待测)偏小,故D不符合题意;
所以答案是:C.
【考点精析】掌握配制一定物质的量浓度的溶液和酸碱中和滴定是解答本题的根本,需要知道配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线;中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点.


科目:高中化学 来源: 题型:
【题目】Ⅰ、磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子结构示意图是 .
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10 10C+P4O10═P4+10CO
每生成1mol P4时,就有mol电子发生转移.
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C6H8O6+I2═C6H6O6+2H++2I﹣ 2S2O32﹣+I2═S4O62﹣+2I﹣
在一定体积的某维生素C溶液中加入a molL﹣1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2 , 消耗b molL﹣1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是mol.
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3﹣+5SO32﹣+2H+═I2+5SO42﹣+H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
0.01molL﹣1 | 0.01molL﹣1 | H2O的体积 | 实验 | 溶液出现蓝色时所需时间/s | |
实验1 | 5 | V1 | 35 | 25 | |
实验2 | 5 | 5 | 40 | 25 | |
实验3 | 5 | 5 | V2 | 0 |
该实验的目的是;表中V2=mL
(5)Ⅱ、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl36H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是 .
(6)在某强酸性混合稀土溶液中加入H2O2 , 调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:Ce3++H2O2+H2O═Ce(OH)4↓+ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2SO4、K2SO4、KCl的混和溶液中,如果c(Cl-)=0.1mol/L,c(Na+)=0.2mol/L,c(SO42-)=xmol/L,c(K+)=ymol/L,则x和y的关系是( )
A. x=0.5y B. 2x=0.1+y C. y=2(x-0.1) D. y=2x+0.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO![]() 、NO
、NO![]() 的相互分离。相应的实验过程可用下图表示:
的相互分离。相应的实验过程可用下图表示:
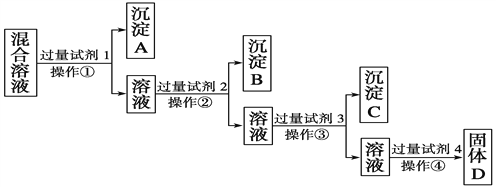
(1)写出上述实验过程中所用试剂的名称:试剂1为______________,试剂2为______________。
(2)控制试剂4的加入量的方法是__________________________。
(3)加入过量试剂3的目的是__________________________________。
(4)操作①的名称是________,在加入试剂4后,获得固体D的实验操作④是______________________(填操作名称)。
(5)写出加入试剂4后发生反应的化学方程式:
__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D都是短周期元素,原子半径D>C>A>B,其中A,B处在同一周期,A,C处在同一主族.C原子核内质子数等于A,B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍.试回答:
(1)这四种元素分别是:A , B , C , D .
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是 .
(3)A与B形成的三原子分子的电子式是 , B与D形成的原子个数比为1:1的化合物的电子式是 .
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为 .
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学知识,请你回答下列问题:
(1)最外层电子排布为4s24p1的原子的核电荷数为 . 某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4 , 该元素的名称是 .
(2)根据VSEPR模型,PO43﹣的分子立体结构为:;乙醇易溶于水的原因是;HClO4的酸性强于HClO的原因是;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体为 .
(4)某元素核外有三个电子层,最外层电子数是核外电子总数的 ![]() ,写出该元素原子的电子排布式是 . 写出铬元素在周期表中的位置 , 它位于区.
,写出该元素原子的电子排布式是 . 写出铬元素在周期表中的位置 , 它位于区.
(5)如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为a pm,氯化铯(CsCl)的相对分子质量M,NA为阿伏伽德罗常数,则氯化铯晶体的密度为g/cm3 . 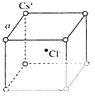
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学,让生活更美好”,下列叙述不能直接体现这一主旨的是
A.风力发电,让能源更清洁B.合成光纤,让通讯更快捷
C.合成药物,让人类更健康D.环保涂料,让环境更宜居
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SnSO4用于合金、马口铁、汽缸活塞、钢丝等酸性电镀,电子器件的光亮镀锡等.另外,还用于铝合金制品涂层氧化着色,印染工业用作媒染剂,有机溶液中双氧水去除剂等.工业上SnSO4的制备路线如图: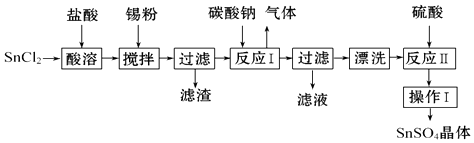
已知:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡.
回答下列问题:
(1)锡原子的核外电子数为50,与碳元素同主族,锡元素在周期表中的位置是 .
(2)操作Ⅰ是、、过滤、洗涤.
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因: .
(4)加入锡粉的作用有两个:①调节溶液pH,② .
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 .
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 .
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,反应为Sn+2HCl═SnCl2+H2↑;
②加过量FeCl3氧化Sn2+生成Sn4+;
③用已知浓度的盐酸酸化过的K2Cr2O7滴定生成的FeCl2 , 反应的化学方程是:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O.
取1.360g锡粉,经上述各步反应后,共用去0.100molL﹣1K2Cr2O7溶液33.00mL,则锡粉中锡的质量分数是 . (保留一位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com