
【题目】根据已学知识,请你回答下列问题:
(1)最外层电子排布为4s24p1的原子的核电荷数为 . 某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4 , 该元素的名称是 .
(2)根据VSEPR模型,PO43﹣的分子立体结构为:;乙醇易溶于水的原因是;HClO4的酸性强于HClO的原因是;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体为 .
(4)某元素核外有三个电子层,最外层电子数是核外电子总数的 ![]() ,写出该元素原子的电子排布式是 . 写出铬元素在周期表中的位置 , 它位于区.
,写出该元素原子的电子排布式是 . 写出铬元素在周期表中的位置 , 它位于区.
(5)如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为a pm,氯化铯(CsCl)的相对分子质量M,NA为阿伏伽德罗常数,则氯化铯晶体的密度为g/cm3 . 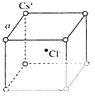
【答案】
(1)31,硒
(2)正四面体,乙醇和水分子之间形成氢键,HClO4分子中非羟基氧多
(3)分子晶体
(4)[Ne]3s2或1s22s22p63s2,第4周期VIB族,d
(5)![]()
【解析】解:(1)最外层电子排布为4s24p1的原子的核电荷数=2+8+18+3=31;某元素原子的外围电子排布是4s24p4,其核内质子数=2+8+18+6=34,为Se元素,
所以答案是:31;硒;
(2)磷酸根离子价层电子对个数为4且不含孤电子对,根据价层电子对互斥理论知磷酸根离子空间构型为正四面体结构;乙醇和水分子之间形成氢键而增大乙醇的溶解性,导致乙醇和水互溶;含氧酸中非羟基O原子个数越多其酸性越强,高氯酸中非羟基氧原子个数大于次氯酸,所以高氯酸酸性大于次氯酸,
所以答案是:正四面体;乙醇与水分子间形成氢键;HClO4分子中非羟基氧多;
(3)氯化铁熔沸点较低,所以为分子晶体,所以答案是:分子晶体;
(4)某元素核外有三个电子层,最外层电子数是核外电子总数的 ![]() ,设其最外层电子数是x,则x=
,设其最外层电子数是x,则x= ![]() ×(2+8+x),x=2,根据构造原理书写其基态原子核外电子排布式为:[Ne]3s2或1s22s22p63s2;Cr位于第四周期第VIB族,位于d区,
×(2+8+x),x=2,根据构造原理书写其基态原子核外电子排布式为:[Ne]3s2或1s22s22p63s2;Cr位于第四周期第VIB族,位于d区,
所以答案是:[Ne]3s2或1s22s22p63s2;第4周期VIB族;d;
(5)晶体中2个最近的Cs+核间距为a pm,位于顶点上相邻的Cs+最近,
则晶胞边长为a×10﹣10cm,晶胞体积=(a×10﹣10)3cm3,该晶胞中氯离子个数是1、Cs+个数=8× ![]() =1,
=1,
其密度= ![]() =
=  g/cm3=
g/cm3= ![]() g/cm3,
g/cm3,
所以答案是: ![]() .
.


科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.若烃中碳、氢元素的质量分数相同,则为同系物
B.CH2═CH2和CH2═CH﹣CH═CH2互为同系物
C.![]() 和
和 ![]() 互为同分异构体
互为同分异构体
D.同分异构体的化学性质可能相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下铜与浓硝酸反应的化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,在反应中被氧化与被还原的原子数之比为( )
A. 1∶2 B. 1∶4 C. 1∶1 D. 2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作会引起实验结果偏高的是( )
A.测定硫酸铜晶体中结晶水含量的实验中,晶体加热完全失去结晶水后,将盛试样的坩埚放在实验桌上自行冷却
B.镀锌铁皮锌镀层厚度测量实验中,将铁皮小火烘干、称量时,最后两次称量前后质量不相等
C.一定浓度的盐酸配制过程中,用量筒量取计算所需的浓盐酸时,仰视观察刻度线
D.滴定实验时,装待测液的滴定管用蒸馏水洗净后,没有用待测液润洗2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学﹣﹣选修物质结构与性质]下表为元素周期表的一部分.请回答下列问题: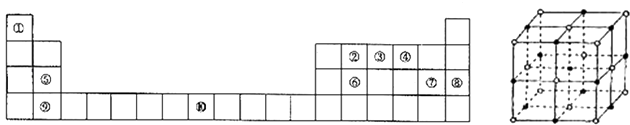
(1)上述元素中,属于s区的是(填元素符号).
(2)写出元素⑩的基态原子的电子排布式 .
(3)元素第一电离能为⑤⑨(填“大于”或“小于”).
(4)元素③气态氢化物的中心原子有对弧对电子,其VSEPR模型为;中心原子的杂化类型为;该分子为分子(填“极性”或“非极性”).向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为 .
(5)元素⑦的钠盐晶胞结构如图所示,每个Na+周围与之距离最近的Na+的个数为 . 若设该晶胞的棱长为a cm,阿伏伽德罗常数的值为NA , 则该钠盐的密度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3 , 含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如图: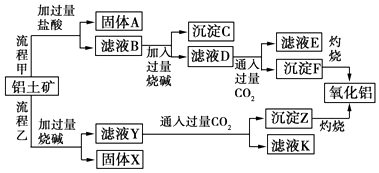
请回答下列问题:
(1)写出流程甲所涉及的离子方程式为、、 .
(2)流程乙加入烧碱后Al2O3发生反应的离子方程式为 .
(3)沉淀C的主要成分是 , 除去沉淀C的操作是 .
(4)滤液D中溶质的主要成分是(填化学式);写出向滤液D中通入过量CO2发生反应的离子方程式 .
(5)在流程中,选用CO2作酸化剂,能不能用盐酸代替CO2 ?其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g)H2(g)+I2(g),2s 时生成0.1mol H2 , 则表示该时段的化学反应速率正确的是( )
A.v(HI)=0.8 molLˉ1sˉ1
B.v(I2)=0.2 molLˉ1sˉ1
C.v(HI)=0.1 molLˉ1minˉ1
D.v(H2)=0.05 molLˉ1sˉ1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过方法区别晶体、准晶体和非晶体.
(2)基态Fe原子有个未成对电子,Fe3+的电子排布式为 . 可用硫氰化钾检验Fe3+ , 现象是 .
(3)根据价层电子对互斥理论判断:SO42﹣的立体构型为 , H3O+的立体构型为 .
(4)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O.乙醛中碳原子的杂化轨道为 , 1mol乙醛分子中含有的σ键的数目为 . Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有个铜原子.
(5)Al单质为面心立方晶体,其晶胞如图.晶胞中铝原子的配位数为 . 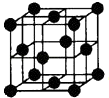
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,某气体A的密度是1.25 g·L-1,则它的摩尔质量是________;该气体在相同温度和压强下其相对于氢气的密度是______。若该气体是单质,同质量的A与氧气所含的分子数之比为_______________。
(2)某物质的相对分子质量为M,在温度为T时的溶解度为S g,此时测得饱和溶液的密度为d g·cm-3,则该饱和溶液中该物质的物质的量浓度为_______(用代数式表示)。
(3)现实验室要用质量分数为40%的浓氢氧化钠(密度为1.2 g·mL-1)来配制浓度为0.6 mol·L-1的稀氢氧化钠100 mL,问需要这种浓碱的体积是______ mL。
(4)下列有关实验操作或判断不正确的是________。
A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏大
B.用干燥的pH试纸测定氯水的pH
C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸并搅拌
D.观察钾元素焰色反应的操作:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察
E.制备氢氧化亚铁时,将盛有NaOH溶液的滴管,伸入硫酸亚铁溶液中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com