
【题目】在一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g)H2(g)+I2(g),2s 时生成0.1mol H2 , 则表示该时段的化学反应速率正确的是( )
A.v(HI)=0.8 molLˉ1sˉ1
B.v(I2)=0.2 molLˉ1sˉ1
C.v(HI)=0.1 molLˉ1minˉ1
D.v(H2)=0.05 molLˉ1sˉ1
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】在呼吸面具和潜水艇中可用过氧化钠作供氧剂。请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。
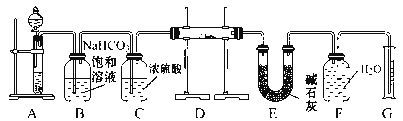
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:____________________。
(2)B、C、E均为除杂装置(U型管中加固体干燥剂)除杂顺序如表:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | _________ |
C | 浓硫酸 | _________ |
E | 碱石灰 | _________ |
(3)写出B中发生反应的离子方程式:__________________________________。
(4)写出D中过氧化钠与二氧化碳反应的化学方程式:__________________。
(5)试管F中收集满气体后,证明试管中收集的气体是氧气的实验操作是:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D都是短周期元素,原子半径D>C>A>B,其中A,B处在同一周期,A,C处在同一主族.C原子核内质子数等于A,B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍.试回答:
(1)这四种元素分别是:A , B , C , D .
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是 .
(3)A与B形成的三原子分子的电子式是 , B与D形成的原子个数比为1:1的化合物的电子式是 .
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学知识,请你回答下列问题:
(1)最外层电子排布为4s24p1的原子的核电荷数为 . 某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4 , 该元素的名称是 .
(2)根据VSEPR模型,PO43﹣的分子立体结构为:;乙醇易溶于水的原因是;HClO4的酸性强于HClO的原因是;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体为 .
(4)某元素核外有三个电子层,最外层电子数是核外电子总数的 ![]() ,写出该元素原子的电子排布式是 . 写出铬元素在周期表中的位置 , 它位于区.
,写出该元素原子的电子排布式是 . 写出铬元素在周期表中的位置 , 它位于区.
(5)如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为a pm,氯化铯(CsCl)的相对分子质量M,NA为阿伏伽德罗常数,则氯化铯晶体的密度为g/cm3 . 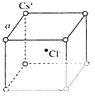
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色澄清溶液中Cl﹣浓度为0.5molL﹣1 , 还可能含有表中的若干种离子.
阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3+ |
阴离子 | NO3﹣ CO32﹣ SiO32﹣ SO42﹣ OH﹣ |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下1.12L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为4.8g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题.
(1)通过以上实验不能确定是否存在的离子有 . 能确定一定不存在的离子是
(2)实验Ⅰ中生成沉淀的离子方程式为 .
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满).
阴离子 | 浓度c/(molL﹣1) |
① | |
② | |
③ |
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学,让生活更美好”,下列叙述不能直接体现这一主旨的是
A.风力发电,让能源更清洁B.合成光纤,让通讯更快捷
C.合成药物,让人类更健康D.环保涂料,让环境更宜居
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生0.58g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
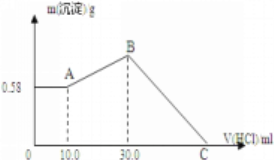
(1)混合物中各物质的物质的量:
NaOH是_______,AlCl3是________,MgCl2是________。
(2)C点所加的盐酸的体积是________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ba(OH)2、CuSO4、HCl可以归为一类,下列物质可以和它们归为一类( )
A. 75%的酒精溶液 B. 硝酸钠 C. Fe(OH)3胶体 D. 豆浆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐中含有一定量的镁、铁等物质,加碘盐中碘的损失主要由于杂质、水份、空气中的氧气以及光照,受热而引起的. 已知:氧化性:IO3﹣>Fe3+>I2还原性:S2O32﹣>I﹣
反应式:3I2+6OH﹣═5I﹣+IO3﹣+3H2O,KI+I2KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+).用适量蒸馏水溶解,并加稀硫酸酸化,将所得溶液分3份:第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入足量的KIO3固体后,滴加淀粉试剂,溶液不变色. ①该红色物质是(用化学式表示);CCl4中显示紫红色的物质是(用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为;
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.写出潮湿环境中KI与氧气反应的化学方程式: . 将I2溶于KI溶液,在低温条件下,可制得KI3H2O.该物质作为食盐加碘剂是否合适?
(填“是”或“否”),并说明理由: .
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 .
A.Na2S2O3
B.AlCl3
C.Na2CO3
D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂.请设计实验方案,检验该加碘盐中的Fe2+: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com