
����Ŀ��ij��ɫ������Һ��Cl��Ũ��Ϊ0.5molL��1 �� �����ܺ��б��е����������ӣ�
������ | K+��Al3+��Mg2+��Ba2+ Fe3+ |
������ | NO3����CO32����SiO32����SO42�� OH�� |
��ȡ����Һ100mL��������ʵ�飨����������ڱ�״���²ⶨ����
��� | ʵ������ | ʵ���� |
�� | �����Һ�м�������ϡ���� | ������ɫ�������ų���״����1.12L���� |
�� | ����ķ�Ӧ���Һ���ˣ��Գ���ϴ�ӡ����������أ��������ù������� | ��������Ϊ4.8g |
�� | ������Һ�еμ�BaCl2��Һ | ���������� |
��ش��������⣮
��1��ͨ������ʵ�鲻��ȷ���Ƿ���ڵ������� �� ��ȷ��һ�������ڵ�������
��2��ʵ��������ɳ��������ӷ���ʽΪ ��
��3��ͨ��ʵ���ͱ�Ҫ���㣬��д��һ�����ڵ������Ӽ���Ũ�ȣ���һ��Ҫ��������
������ | Ũ��c/��molL��1�� |
�� | |
�� | |
�� |
��4���ж�K+�Ƿ���ڣ������ڣ��������СŨ�ȣ���������˵�����ɣ� ��
���𰸡�
��1��OH����NO3��,Al3+��Mg2+��Ba2+��Fe3+��SO42��
��2��SiO32��+2H+=H2SiO3��
��3��CO32��,0.5mol/L,SiO32��,0.8mol/L
��4������,�ɵ���غ��֪��СŨ��Ϊ3.1mol?L��1
���������⣺������ҺΪ������Һ��֪����Һ�к��е�����һ���ܹ��ܴ������棻��ʵ����֪������Һ��һ������CO32������Ũ��Ϊ ![]() =0.5mol/L����һ��û��Al3+��Mg2+��Ba2+ Fe3+�������ɰ�ɫ�����ж���Һ��һ������SiO32����������ӦSiO32��+2H+=H2SiO3����������ȷֽ����ɶ������裬��������Ϊ4.8gΪ������������������ݹ�ԭ���غ㣬SiO32����Ũ��Ϊ
=0.5mol/L����һ��û��Al3+��Mg2+��Ba2+ Fe3+�������ɰ�ɫ�����ж���Һ��һ������SiO32����������ӦSiO32��+2H+=H2SiO3����������ȷֽ����ɶ������裬��������Ϊ4.8gΪ������������������ݹ�ԭ���غ㣬SiO32����Ũ��Ϊ ![]() =0.8mol/L����ʵ����֪��Һ�в���SO42�������ݵ���غ�2c��CO32����+2c��SiO32����=2��0.5mol/L+2��0.8mol/L=3.1mol/L����Һ��һ������K+������Ũ������Ϊ3.1mol/L������ȷ��OH����NO3���Ƿ���ڣ�
=0.8mol/L����ʵ����֪��Һ�в���SO42�������ݵ���غ�2c��CO32����+2c��SiO32����=2��0.5mol/L+2��0.8mol/L=3.1mol/L����Һ��һ������K+������Ũ������Ϊ3.1mol/L������ȷ��OH����NO3���Ƿ���ڣ�
��1��ͨ������ʵ�鲻��ȷ���Ƿ���ڵ�������OH����NO3����ȷ��һ�������ڵ�������Al3+��Mg2+��Ba2+��Fe3+��SO42����
�ʴ�Ϊ��OH����NO3����Al3+��Mg2+��Ba2+��Fe3+��SO42����
��2�������ɰ�ɫ�����ж���Һ��һ������SiO32����������ӦSiO32��+2H+=H2SiO3����
�ʴ�Ϊ��SiO32��+2H+=H2SiO3����
��3���������ϼ����֪��c��CO32����=0.5mol/L��c��SiO32����=0.8mol/L��һ����������������ӣ���c��SO42����=0��
�ʴ�Ϊ��
������ | Ũ��c/��molL��1�� |
��CO32�� | 0.5mol/L |
��SiO32�� | 0.8mol/L |
;
��4�����ݵ���غ�2c��CO32����+2c��SiO32����+c��Cl����=2��0.5mol/L+2��0.8mol/L+0.5mol/L=3.1mol/L����Һ��һ������K+������Ũ������Ϊ3.1mol/L��
�ʴ�Ϊ�����ڣ��ɵ���غ��֪��СŨ��Ϊ3.1molL��1��
������ҺΪ������Һ��֪����Һ�к��е�����һ���ܹ��ܴ������棻��ʵ����֪������Һ��һ������CO32������Ũ��Ϊ![]() =0.5mol/L����һ��û��Al3+��Mg2+��Ba2+ Fe3+�������ɰ�ɫ�����ж���Һ��һ������SiO32����������ӦSiO32��+2H+=H2SiO3����������ȷֽ����ɶ������裬��������Ϊ4.8gΪ������������������ݹ�ԭ���غ㣬SiO32����Ũ��Ϊ
=0.5mol/L����һ��û��Al3+��Mg2+��Ba2+ Fe3+�������ɰ�ɫ�����ж���Һ��һ������SiO32����������ӦSiO32��+2H+=H2SiO3����������ȷֽ����ɶ������裬��������Ϊ4.8gΪ������������������ݹ�ԭ���غ㣬SiO32����Ũ��Ϊ ![]() =0.8mol/L����ʵ����֪��Һ�в���SO42�������ݵ���غ�2c��CO32����+2c��SiO32����=2��0.5mol/L+2��0.8mol/L=3.1mol/L����Һ��һ������K+������Ũ������Ϊ3.1mol/L������ȷ��OH����NO3���Ƿ���ڣ��ݴ˽��.
=0.8mol/L����ʵ����֪��Һ�в���SO42�������ݵ���غ�2c��CO32����+2c��SiO32����=2��0.5mol/L+2��0.8mol/L=3.1mol/L����Һ��һ������K+������Ũ������Ϊ3.1mol/L������ȷ��OH����NO3���Ƿ���ڣ��ݴ˽��.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������·���ʽ����1����2��д���ӷ���ʽ����3����4����5����6��д��ѧ����ʽ
��1��Na��H2O��_____________________________________________
��2��Al��NaOH��Һ��__________________________________________
��3����ɫ����������ɫ�����ɫ��____________________________________
��4���ƴ�Si��___________________________________________________
��5��Na��O2���ȣ� __________________________________________
��6������CO2ͨ��Na2SiO3��Һ�� __________________________________________________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��������������ȷ���ǣ�������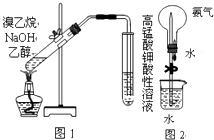
A.��ͼ1��������������NaOHˮ��Һ���Ȳ�������ϩ
B.��ͼ2������Ȫʵ��ʱ�ȼ�ѹ��ͷ�ιܣ����ɿ�ֹˮ��
C.����к͵ζ�ǰ���ζ��ܺ���ƿ��������ˮϴ�Ӻ�����ô�װ��Һ��ϴ
D.��������ƽ��ȡ1.06g��ˮ̼���ƣ�����250mLˮ������0.04molL��1Na2CO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ�����ʽṹ������]�±�ΪԪ�����ڱ���һ���֣���ش��������⣺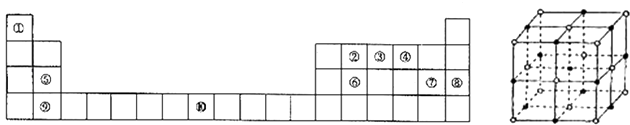
��1������Ԫ���У�����s����������Ԫ�ط��ţ���
��2��д��Ԫ�آ�Ļ�̬ԭ�ӵĵ����Ų�ʽ ��
��3��Ԫ�ص�һ������Ϊ���ᣨ����ڡ���С�ڡ�����
��4��Ԫ�آ���̬�⻯�������ԭ�����Ի��Ե��ӣ���VSEPRģ��Ϊ������ԭ�ӵ��ӻ�����Ϊ���÷���Ϊ���ӣ�����ԡ��Ǽ��ԡ�����������ͭ��Һ����μ�����ˮ��Һ���ɹ۲쵽������Ϊ ��
��5��Ԫ�آߵ����ξ����ṹ��ͼ��ʾ��ÿ��Na+��Χ��֮���������Na+�ĸ���Ϊ �� ����þ������ⳤΪa cm������٤��������ֵΪNA �� ������ε��ܶ�Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ķ�Ӧ·��������Ϣ��գ� 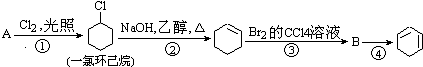
��1��A�Ľṹ��ʽ�� �� ������ ��
��2���ٵķ�Ӧ������ �� �ڵķ�Ӧ������ ��
��3����Ӧ�ܵĻ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���1L�ܱ������м���1mol HI��g����������Ӧ2HI��g��H2��g��+I2��g����2s ʱ����0.1mol H2 �� ���ʾ��ʱ�εĻ�ѧ��Ӧ������ȷ���ǣ� ��
A.v��HI��=0.8 molL��1s��1
B.v��I2��=0.2 molL��1s��1
C.v��HI��=0.1 molL��1min��1
D.v��H2��=0.05 molL��1s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���üױ��������ǻ����������� ![]() ������������ͼ��
������������ͼ��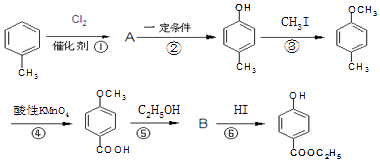
��1�����ǻ������������ķ���ʽΪ��1mol ��������NaOH��Һ��ȫ��Ӧ���������molNaOH��
��2��������A�еĹ����������� �� ��Ӧ�ܵķ�Ӧ������ ��
��3����Ӧ�ٵĻ�ѧ����ʽ ��
��4���л���C�����ӹ���Ϊ 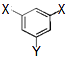 ����X����YΪȡ�������Ƕ��ǻ�������������ͬ���칹�����ܷ���������Ӧ����X�Ľṹ��ʽ�������� ��
����X����YΪȡ�������Ƕ��ǻ�������������ͬ���칹�����ܷ���������Ӧ����X�Ľṹ��ʽ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3Ԫ�ص�����RX����Mn+��Zm+����ͬ�ĵ��Ӳ�ṹ����֪n��m���Ƕ�Ӧ��ԭ��������ϵΪ�� ��
A.R��M��ZB.M��R��ZC.M��Z��RD.Z��M��R
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������װ���Ʊ�������Cl2�����ʣ�����˵����ȷ���ǣ� ��
A.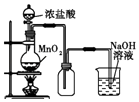 ͼ�У����MnO2������Ũ����Ϳ�ȫ������
ͼ�У����MnO2������Ũ����Ϳ�ȫ������
B.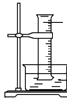 ͼ�У�������õ���Ͳ������������ˮ����װ��ˮ�����㹻����ʱ����գ���Ͳ�����ʣ������ΪHCl������
ͼ�У�������õ���Ͳ������������ˮ����װ��ˮ�����㹻����ʱ����գ���Ͳ�����ʣ������ΪHCl������
C.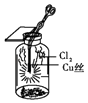 ͼ�У�������ɫ����
ͼ�У�������ɫ����
D.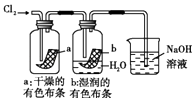 ͼ�У�ʪ�����ɫ��������ɫ����������Һ�����ձ��У�����Һ�����ԣ������Cl2����
ͼ�У�ʪ�����ɫ��������ɫ����������Һ�����ձ��У�����Һ�����ԣ������Cl2����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com