
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过方法区别晶体、准晶体和非晶体.
(2)基态Fe原子有个未成对电子,Fe3+的电子排布式为 . 可用硫氰化钾检验Fe3+ , 现象是 .
(3)根据价层电子对互斥理论判断:SO42﹣的立体构型为 , H3O+的立体构型为 .
(4)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O.乙醛中碳原子的杂化轨道为 , 1mol乙醛分子中含有的σ键的数目为 . Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有个铜原子.
(5)Al单质为面心立方晶体,其晶胞如图.晶胞中铝原子的配位数为 . 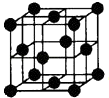
【答案】
(1)X射线衍射
(2)4,1s22s22p63s23p63d5,形成血红色溶液
(3)正四面体,三角锥
(4)sp3、sp2,6NA,16
(5)12
【解析】解:(1)从外观无法区分三者,但用X光照射会发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无衍射现象即可确定;
(2)26号元素Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,失去电子变为铁离子时,先失去4s上的2个电子后失去3d上的1个电子,因此Fe3+的电子排布式为1s22s22p63s23p63d5,硫氰化铁为血红色,所以硫氰化钾检验Fe3+,现象是形成血红色溶液;
(3)SO42﹣中心原子S原子成4个σ键、没有孤对电子,价层电子对个数=σ键个数+孤电子对个数=4+0=4,杂化轨道数为4,采取sp3杂化,SO42﹣的立体构型是正四面体;H3O+的中心原子O价层电子对个数=3 ![]() =4,采取sp3杂化,有一对孤电子对,分子构型为三角锥型;
=4,采取sp3杂化,有一对孤电子对,分子构型为三角锥型;
(4)乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化类型;1个乙醛分子含有6个σ键和一个π键,则1mol乙醛含有6molσ键,即6NA个σ键;该晶胞中O原子数为4×1+6× ![]() +8×
+8× ![]() =8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个;
=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个;
(5)在Al晶体的一个晶胞中与它距离相等且最近的Al原子在通过这个顶点的三个面心上,面心占 ![]() ,通过一个顶点可形成8个晶胞,因此该晶胞中铝原子的配位数为8×3×
,通过一个顶点可形成8个晶胞,因此该晶胞中铝原子的配位数为8×3× ![]() =12;
=12;
所以答案是:(1)X射线衍射;(2)4;1s22s22p63s23p63d5;形成血红色溶液;(3)正四面体;三角锥;(4)sp3、sp2;6NA;16;(5)12.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】在Na2SO4、K2SO4、KCl的混和溶液中,如果c(Cl-)=0.1mol/L,c(Na+)=0.2mol/L,c(SO42-)=xmol/L,c(K+)=ymol/L,则x和y的关系是( )
A. x=0.5y B. 2x=0.1+y C. y=2(x-0.1) D. y=2x+0.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学知识,请你回答下列问题:
(1)最外层电子排布为4s24p1的原子的核电荷数为 . 某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4 , 该元素的名称是 .
(2)根据VSEPR模型,PO43﹣的分子立体结构为:;乙醇易溶于水的原因是;HClO4的酸性强于HClO的原因是;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体为 .
(4)某元素核外有三个电子层,最外层电子数是核外电子总数的 ![]() ,写出该元素原子的电子排布式是 . 写出铬元素在周期表中的位置 , 它位于区.
,写出该元素原子的电子排布式是 . 写出铬元素在周期表中的位置 , 它位于区.
(5)如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为a pm,氯化铯(CsCl)的相对分子质量M,NA为阿伏伽德罗常数,则氯化铯晶体的密度为g/cm3 . 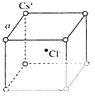
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学,让生活更美好”,下列叙述不能直接体现这一主旨的是
A.风力发电,让能源更清洁B.合成光纤,让通讯更快捷
C.合成药物,让人类更健康D.环保涂料,让环境更宜居
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生0.58g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
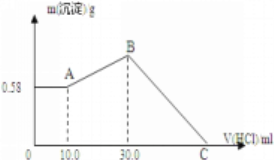
(1)混合物中各物质的物质的量:
NaOH是_______,AlCl3是________,MgCl2是________。
(2)C点所加的盐酸的体积是________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ba(OH)2、CuSO4、HCl可以归为一类,下列物质可以和它们归为一类( )
A. 75%的酒精溶液 B. 硝酸钠 C. Fe(OH)3胶体 D. 豆浆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SnSO4用于合金、马口铁、汽缸活塞、钢丝等酸性电镀,电子器件的光亮镀锡等.另外,还用于铝合金制品涂层氧化着色,印染工业用作媒染剂,有机溶液中双氧水去除剂等.工业上SnSO4的制备路线如图: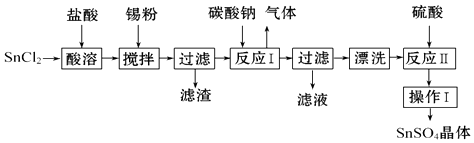
已知:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡.
回答下列问题:
(1)锡原子的核外电子数为50,与碳元素同主族,锡元素在周期表中的位置是 .
(2)操作Ⅰ是、、过滤、洗涤.
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因: .
(4)加入锡粉的作用有两个:①调节溶液pH,② .
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 .
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 .
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,反应为Sn+2HCl═SnCl2+H2↑;
②加过量FeCl3氧化Sn2+生成Sn4+;
③用已知浓度的盐酸酸化过的K2Cr2O7滴定生成的FeCl2 , 反应的化学方程是:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O.
取1.360g锡粉,经上述各步反应后,共用去0.100molL﹣1K2Cr2O7溶液33.00mL,则锡粉中锡的质量分数是 . (保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体必需的微量元素,在肺部,血红蛋白中血红素的Fe2+与O2结合,把O2送到各个组织器官。铁摄入不足可能引起缺铁性贫血。黑木耳中含有比较丰富的铁元素,某研学小组测定其含量。
(1)【铁元素的分离】 称量黑木耳,将之洗净切碎,用蒸馏水浸泡,但浸泡液中未能检测到铁元素。在坩埚中高温灼烧黑木耳,使之完全灰化。用酸充分溶解,过滤,滤液备用。
①浸泡液检测不出铁元素的原因是________。
②滤液中铁元素的存在形式是Fe2+、________。
(2)【配制溶液】 将滤液配制成100 mL 溶液。选择合适的仪器完成“铁元素的分离”、
“配制溶液”2个实验,下列仪器不必使用的是_______。

(3)【铁元素含量测定】 研学小组提出如下测量方案:
Ⅰ.沉淀法:向溶液中加入足量NaOH溶液,过滤、洗涤沉淀、加热烘干、称量。评价该测量方案是否可行________。
Ⅱ.比色法:流程示意如下:
![]()
① 用离子方程式解释加入H2O2的目的是________。
② 溶液a的颜色是________。
③ 溶液颜色越深,光的透过能力越差,即透光率越小。若不加H2O2,测出黑木耳中铁元素的含量________(填“偏大”或“偏小”)。
(4)亚铁盐易被氧化,但在体内Fe2+参与O2的运输却不被氧化。蛋白质是一种既有亲水部分、又有疏水部分的大分子,为血红素提供了疏水环境。

可见,氧化还原反应能否发生与_________有关。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com