
【题目】下列微粒中与OH-离子具有相同的质子数和相同的电子数,该微粒可能为
A.F-B.Mg2+C.NH4+D.CH4
科目:高中化学 来源: 题型:
【题目】用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按下列步骤分离五种离子,则溶液①、②、③、④是 ( )
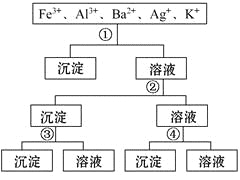
A. ①NaCl ②NaOH ③NH3·H2O ④H2SO4
B. ①H2SO4②NaOH ③NH3·H2O ④NaCl
C. ①H2SO4②NH3·H2O ③NaOH ④NaCl
D. ①NaCl ②NH3·H2O ③NaOH ④H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3 , 含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如图: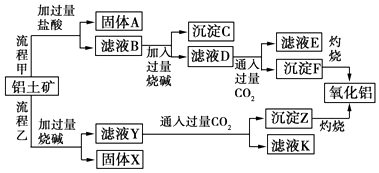
请回答下列问题:
(1)写出流程甲所涉及的离子方程式为、、 .
(2)流程乙加入烧碱后Al2O3发生反应的离子方程式为 .
(3)沉淀C的主要成分是 , 除去沉淀C的操作是 .
(4)滤液D中溶质的主要成分是(填化学式);写出向滤液D中通入过量CO2发生反应的离子方程式 .
(5)在流程中,选用CO2作酸化剂,能不能用盐酸代替CO2 ?其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法规范的是( )
A. 98g稀硫酸所含分子数为1mol B. 氧的摩尔质量为32g/mol
C. 某硫酸溶液中H2SO4的质量分数为60% D. 标准状况下,1mol气体的体积约为22.4L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过方法区别晶体、准晶体和非晶体.
(2)基态Fe原子有个未成对电子,Fe3+的电子排布式为 . 可用硫氰化钾检验Fe3+ , 现象是 .
(3)根据价层电子对互斥理论判断:SO42﹣的立体构型为 , H3O+的立体构型为 .
(4)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O.乙醛中碳原子的杂化轨道为 , 1mol乙醛分子中含有的σ键的数目为 . Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有个铜原子.
(5)Al单质为面心立方晶体,其晶胞如图.晶胞中铝原子的配位数为 . 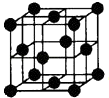
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醚是工业上的常用方法,该方法由以下几步组成: 2H2(g)+CO(g)CH3OH(g)△H=﹣90.0kJmol﹣1①
2CH3OH(g)CH3OCH3(g)+H2O(g)△H=﹣24.5kJmol﹣1②
CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41.1kJmol﹣1③
(1)下列说法正确的是
A.反应①的△S<0、△H<0,所以能在较低温度下自发进行.
B.反应③的H2O与CO的生成速率之比为1:1时,表示该反应已经达到平衡状态
C.反应②属于加成反应
(2)反应①合成的甲醇在工业上可以用作燃料电池,请写出甲醇燃料电池(KOH溶液)负极电极反应式 .
(3)当合成气中CO与H2的物质的量之比恒定时,温度、压强对CO转化率影响如图1所示,图1中A点的v(逆)B点的v(正)(填“>”、“<”或“=”),说明理由 . 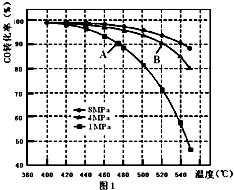
(4)一定温度下,密闭容器中发生反应③,该反应的平衡常数表达式k=;水蒸气的转化率与 ![]() 的关系如图2,计算该温度下反应③的平衡常数K= .
的关系如图2,计算该温度下反应③的平衡常数K= . 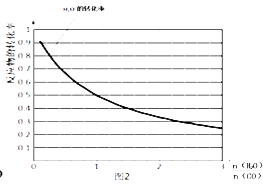
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
A.标准状况下,22.4 L NO与11.2 L O2充分反应后得到的气体分子数为NA
B.3.6 g重水中含有的中子数为2NA
C.一定条件下,6.4 g铜与过量的硫酸反应,转移电子数目为0.2NA
D.常温下,1 L 1 molL﹣1的CH3COOH溶液中,所含溶质分子数小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体( Na2MoO42H2O)是一种无公害型冷却水系统的金属缓蚀剂.工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图1所示: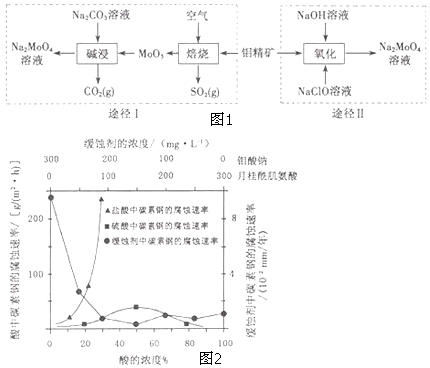
(1)NaClO的电子式是 .
(2)为了提高焙烧效率,除增大空气量外还可以采用的措施是 .
(3)途径I碱浸时发生反应的离子方程式为 .
(4)途径Ⅱ氧化时发生反应的离子方程式为 .
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂.常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图2:
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为 .
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 .
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸式滴定管准确移取10.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20molL ﹣1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.50mL | 18.60mL |
第二次 | 0.70mL | 19.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为molL﹣1 .
(2)达到滴定终点的标志是 .
(3)以下操作造成测定结果偏高的原因可能是 . A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com