
【题目】用酸式滴定管准确移取10.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20molL ﹣1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.50mL | 18.60mL |
第二次 | 0.70mL | 19.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为molL﹣1 .
(2)达到滴定终点的标志是 .
(3)以下操作造成测定结果偏高的原因可能是 . A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液.
【答案】
(1)0.364
(2)无色变为红色,且30s内不变色
(3)A、D
【解析】解:(1)由表格数据可知V(NaOH)= ![]() =18.2mL、c(HCl)=
=18.2mL、c(HCl)= ![]() =
= ![]() =0.364mol/L,所以答案是:0.364;(2)碱滴定酸,使用酚酞作指示剂,开始为无色,滴定终点为红色,则达到滴定终点的标志是无色变为红色,且30s内不变色,
=0.364mol/L,所以答案是:0.364;(2)碱滴定酸,使用酚酞作指示剂,开始为无色,滴定终点为红色,则达到滴定终点的标志是无色变为红色,且30s内不变色,
所以答案是:无色变为红色,且30s内不变色;(3)A.未用标准液润洗碱式滴定管,消耗V(NaOH)偏大,由c(HCl)= ![]() 可知,测定结果偏高,故A选;
可知,测定结果偏高,故A选;
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确,V(NaOH)偏小,由c(HCl)= ![]() 可知,测定结果偏低,故B不选;
可知,测定结果偏低,故B不选;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,HCl的物质的量不变,消耗NaOH的物质的量不变,对实验无影响,故C不选;
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液.V(NaOH)偏大,由c(HCl)= ![]() 可知,测定结果偏高,故D选;
可知,测定结果偏高,故D选;
所以答案是:AD.
【考点精析】利用酸碱中和滴定对题目进行判断即可得到答案,需要熟知中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点.


科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图) 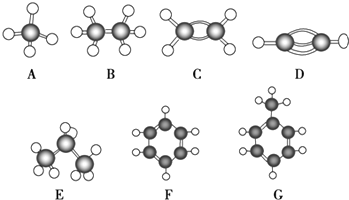
据此回答下列问题:
(1)常温下含碳量最高的气态烃是(填对应字母).
(2)能够发生加成反应的烃有(填数字)种.
(3)一卤代物种类最多的是(填对应字母) .
(4)写出实验室制取C的化学方程式 .
(5)写出F发生溴代反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( ) 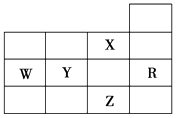
A.W元素的电负性大于Y元素的电负性
B.X元素是电负性最大的元素
C.p能级未成对电子最多的是Z元素
D.Y,Z的阴离子电子层结构都与R原子的相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体必需的微量元素,在肺部,血红蛋白中血红素的Fe2+与O2结合,把O2送到各个组织器官。铁摄入不足可能引起缺铁性贫血。黑木耳中含有比较丰富的铁元素,某研学小组测定其含量。
(1)【铁元素的分离】 称量黑木耳,将之洗净切碎,用蒸馏水浸泡,但浸泡液中未能检测到铁元素。在坩埚中高温灼烧黑木耳,使之完全灰化。用酸充分溶解,过滤,滤液备用。
①浸泡液检测不出铁元素的原因是________。
②滤液中铁元素的存在形式是Fe2+、________。
(2)【配制溶液】 将滤液配制成100 mL 溶液。选择合适的仪器完成“铁元素的分离”、
“配制溶液”2个实验,下列仪器不必使用的是_______。

(3)【铁元素含量测定】 研学小组提出如下测量方案:
Ⅰ.沉淀法:向溶液中加入足量NaOH溶液,过滤、洗涤沉淀、加热烘干、称量。评价该测量方案是否可行________。
Ⅱ.比色法:流程示意如下:
![]()
① 用离子方程式解释加入H2O2的目的是________。
② 溶液a的颜色是________。
③ 溶液颜色越深,光的透过能力越差,即透光率越小。若不加H2O2,测出黑木耳中铁元素的含量________(填“偏大”或“偏小”)。
(4)亚铁盐易被氧化,但在体内Fe2+参与O2的运输却不被氧化。蛋白质是一种既有亲水部分、又有疏水部分的大分子,为血红素提供了疏水环境。

可见,氧化还原反应能否发生与_________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法正确的是( ) 
A.相对于途径②,途径①更好地体现了绿色化学思想
B.X可能是SO2和SO3的混合气体
C.Y可以是葡萄糖溶液
D.将CuSO4溶液蒸发,利用余热蒸干,可制得胆矾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究铜及其化合物的性质对科研、生产生活有重要的意义.
(1)铜可采用如下方法制备
①火法炼铜:Cu2S+O2![]() 2Cu+SO2
2Cu+SO2
②湿法炼铜:CuSO4+Fe═FeSO4+Cu
上述两种方法中,铜元素均被 (填“氧化”或“还原”)成铜单质,若用①法每制得32gCu,转移电子的物质的量是 .
(2)在潮湿的空气中铜可以发生电化学腐蚀,生成铜绿,铜绿的化学式为 发生腐蚀的正极反应式为 ,由铜和锌组成的黄铜合金不易生锈,其防腐蚀的方法是 .
(3)①Li﹣﹣CuO电池总反应为:2Li+CuO═Li2O+Cu.电解质溶液为高氯酸锂有机溶液,电池的正极反应式为 .
②Cu2O是一种半导体材料,可在碱性溶液中用电解法制取,电解总反应式为:
2Cu+H2O![]() Cu2O+H2↑,阳极反应式为 ;Cu2O投入稀硫酸中,得到蓝色溶液和红色沉淀,写出该反应的离子方程式 .
Cu2O+H2↑,阳极反应式为 ;Cu2O投入稀硫酸中,得到蓝色溶液和红色沉淀,写出该反应的离子方程式 .
(4)为了回收粗铜精炼后阳极泥中的Ag和Au,某实验小组查阅了有关资料如下表:
编号 | 常温下反应 | 化学平衡常数 |
反应甲 | Au+6HNO3Au(NO3)3+3NO2↑+3H2O | <10﹣5 |
反应乙 | Au3++4Cl﹣[AuCl4]﹣ | >105 |
从资料中可知,常温下金很难与硝酸反应,但却可溶于王水(浓硝酸与浓盐酸体积比为l:3的混合物).请你运用化学平衡移动原理,简要说明金能溶于王水的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】16O中的16的含义是
A.氧元素的相对原子质量B.氧元素的一种同位素的相对原子质量
C.氧元素的近似相对原子质量D.氧元素的一种同位素的质量数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com