
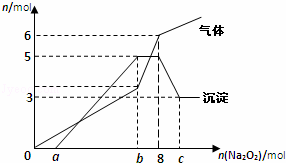
 将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+的物质的量分别为( )
将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+的物质的量分别为( )| A. | 2mol、3mol、6mol | B. | 3mol、2mol、6mol | C. | 2mol、3mol、4mol | D. | 3mol、2mol、2mol |
分析 据图象中沉淀的量的变化情况可以推知镁离子的物质的量为3mol,氢氧化铝和氢氧化镁沉淀一共是5mol;
根据元素守恒,所以含有铝离子的物质的量2mol;
根据生成气体的量的增加趋势,可知生成的气体除了过氧化钠和溶液反应生成的氧气之外,还有氨根离子与氢氧根离子反应生成氨气,
图象中加入过氧化钠的物质的量在0~amol之间时,所得沉淀量为0,与溶液中的氢离子反应,结合气体的图象分析,加入8mol过氧化钠时,共生成气体6mol,由反应方程式2Na2O2+2H2O=4NaOH+O2↑可知2mol的过氧化钠生成1mol的氧气,所以8mol的过氧化钠生成4mol的氧气,则生成氨气是2mol,根据氮守恒分析解答.
解答 解:根据图象中沉淀的量的变化情况可以推知镁离子的物质的量为3mol,氢氧化铝和氢氧化镁沉淀一共是5mol;
根据元素守恒,所以含有铝离子的物质的量2mol;
根据生成气体的量的增加趋势,可知生成的气体除了过氧化钠和溶液反应生成的氧气之外,还有氨根离子与氢氧根离子反应生成氨气,
图象中加入过氧化钠的物质的量在0~amol之间时,所得沉淀量为0,与溶液中的氢离子反应,结合气体的图象分析,加入8mol过氧化钠时,共生成气体6mol,由反应方程式2Na2O2+2H2O=4NaOH+O2↑可知2mol的过氧化钠生成1mol的氧气,所以8mol的过氧化钠生成4mol的氧气,则生成氨气是2mol,所以铵根离子为2mol,则原溶液中的Mg2+、Al3+、NH4+的物质的量分别为3mol、2mol、2mol,故选D.
点评 本题是一道有关离子检验的综合知识题目,考察角度很广,难度较大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:实验题
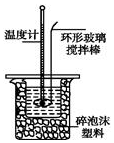 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 试验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、SO42-、Cl- | B. | Na+、Fe2+、SO42-、NO3- | ||
| C. | Al3+、Na+、Cl-、AlO2- | D. | K+、Cu2+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
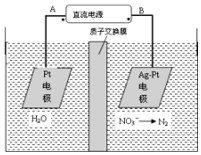 电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图,请写出阴极的电极反应式2NO3-+12H++10e-=N2↑+6H2O.
电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图,请写出阴极的电极反应式2NO3-+12H++10e-=N2↑+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
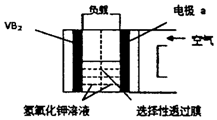 硼化钒(VB2)-空气电池是目前储电能力最高的电池(如图所示),电池总反应为:4VB2+11O2═4B2O3+2V2O5,下列叙述错误的是( )
硼化钒(VB2)-空气电池是目前储电能力最高的电池(如图所示),电池总反应为:4VB2+11O2═4B2O3+2V2O5,下列叙述错误的是( )| A. | 负极反应式为4VB2+44OH-═2V2O5+4B2O3+22H2O | |
| B. | 正极反应式为11O2+44e-+22H2O=44OH- | |
| C. | OH-由负极透过性选择性透过膜向正极迁移 | |
| D. | 电子由硼化钒电极负载流向电极a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄酒中添加SO2,可起到抗氧化和抗菌的作用 | |
| B. | PM2.5颗粒分散到空气中可产生丁达尔效应 | |
| C. | 苯、四氯化碳、乙醇都可作萃取剂,也都能燃烧 | |
| D. | 淀粉、油脂、纤维素和蛋白质都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
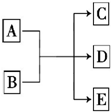 一定条件下,物质A~E转化关系如图所示,其中A为单质,常温下E为无色液体.
一定条件下,物质A~E转化关系如图所示,其中A为单质,常温下E为无色液体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com