
| A、氢硫酸、烧碱、明矾 |
| B、硫酸、纯碱、石膏 |
| C、硝酸、乙醇、醋酸钠 |
| D、磷酸、熟石灰、苛性钠 |


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
| A、△H的大小与热化学方程式的化学计量数无关 |
| B、生成物的总焓大于反应物的总焓时,反应吸热,△H>0 |
| C、在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| D、破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,该反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量的CO和CO2中所含碳原子数相等 |
| B、2mol H2O和2mol NH3含电子数相同 |
| C、等质量的O2和O3中所含氧原子个数相同 |
| D、H2SO4的摩尔质量是98g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4℃时9mL水和标准状况下11.2L氮气含有相同的原子数 |
| B、27g金属铝与足量的盐酸反应时,失去的电子数为2NA |
| C、常温常压下,48gO3含有的氧原子数为3NA |
| D、5.6gC2H4和C4H8混合气中含氢原子数为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜溶于FeCl3溶液:Cu+Fe3+=Cu2++Fe2+ |
| B、Na[Al(OH)4]溶液中通入过量CO2:[Al(OH)4]-+CO2=Al(OH)3↓+CO32- |
| C、氯化铝溶液中加过量氨水:Al3++3OH-═Al(OH)3↓ |
| D、次氯酸钠溶液中滴入浓盐酸产生氯气:ClO-+Cl-+2H+=Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
| Kw/10-14 | 0.134 | 0.292 | 0.681 | 1.00 | 2.92 | 5.57 | 38.0 | 55.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
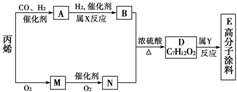 有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程生产的.图中M(C3H4O)和A均能发生银镜反应.N和M的分子中碳原子数相同,A的烃基上的一氯取代位置有三种.
有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程生产的.图中M(C3H4O)和A均能发生银镜反应.N和M的分子中碳原子数相同,A的烃基上的一氯取代位置有三种.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y形成的多种单质,其中之一是地球生物的“保护伞” |
| Z | Z的基态原子核外p能级总电子数比s能级总电子数少一个 |
| M | M存在质量数为27,中子数为14的核素 |
| W | W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com