已知25℃时草酸的电离常数为K
1=5.0×10
-2,K
2=5.4×10
-5,草酸钙的K
sp=4.0×10
-8,碳酸钙的K
sp=2.5×10
-9.不同温度下水的离子积常数见下表:
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
| Kw/10-14 | 0.134 | 0.292 | 0.681 | 1.00 | 2.92 | 5.57 | 38.0 | 55.0 |
(1)常温下将0.2mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合后溶液显酸性,则混合后溶液中各离子浓度的大小顺序为
;
(2)已知草酸能使酸性高锰酸钾溶液(稀硫酸酸化)褪色,试写出反应的离子方程式:
;
若在锥形瓶中放入20.00mL未知浓度的草酸,用0.1mol/L高锰酸钾溶液滴定,当到达滴定终点时,溶液颜色的变化是
;若共消耗VmL高锰酸钾溶液,则草酸的物质的量浓度为
mol/L.
(2)90℃时,将0.005mol/L的氢氧化钙溶液20mL与0.0012mol/L的草酸溶液20mL混合,则混合后溶液中各离子浓度的大小顺序为
;
(3)25℃时向氢氧化钙溶液中加入0.1mol/L碳酸钠溶液充分搅拌,有白色的碳酸钙沉淀生成,当溶液的pH=11时,c(CO
32-)=
mol/L;
若向20mL草酸钙的饱和溶液中逐滴加入8.0×10
-4mol/L的碳酸钾溶液10mL,能否产生沉淀,
(填“能”或“否”).



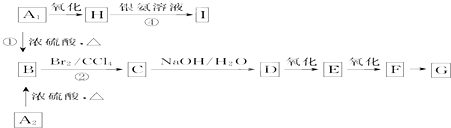
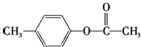 、
、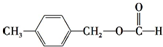 外,其余的结构简式为
外,其余的结构简式为