
 ,C是S元素,主族元素的最外层电子就是其外围电子,则S原子的外围电子排布式为3s23p4,B是Na元素,A是O元素,Na2O中氧离子和钠离子之间存在离子键,所以氧化钠的电子式为:
,C是S元素,主族元素的最外层电子就是其外围电子,则S原子的外围电子排布式为3s23p4,B是Na元素,A是O元素,Na2O中氧离子和钠离子之间存在离子键,所以氧化钠的电子式为: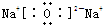 ;
; ;3s23p4;
;3s23p4;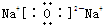 ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、氯化钠溶于水 |
| B、NH3(g)与HCl(g)反应生成NH4Cl(s) |
| C、干冰(CO2)的升华 |
| D、CaCO3(s)分解为CaO(s)和CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4℃时9mL水和标准状况下11.2L氮气含有相同的原子数 |
| B、27g金属铝与足量的盐酸反应时,失去的电子数为2NA |
| C、常温常压下,48gO3含有的氧原子数为3NA |
| D、5.6gC2H4和C4H8混合气中含氢原子数为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
| Kw/10-14 | 0.134 | 0.292 | 0.681 | 1.00 | 2.92 | 5.57 | 38.0 | 55.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
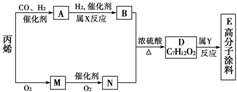 有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程生产的.图中M(C3H4O)和A均能发生银镜反应.N和M的分子中碳原子数相同,A的烃基上的一氯取代位置有三种.
有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程生产的.图中M(C3H4O)和A均能发生银镜反应.N和M的分子中碳原子数相同,A的烃基上的一氯取代位置有三种.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:T>W>Z>Y |
| B、W与T的单质可通过电解饱和的WT水溶液获得 |
| C、Z与W形成的两种化合物中化学键类型完全相同 |
| D、元素X、Z与T可形成多种酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
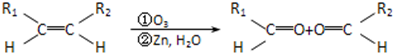
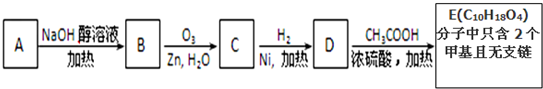
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com