考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W是元素周期表前四周期中的常见元素,
X的基态原子L层电子数是K层电子数的2倍,则L层电子数为4,则X是C元素;
Y形成的多种单质,其中之一是地球生物的“保护伞”臭氧,则Y是O元素;
Z的基态原子核外p能级总电子数比s能级总电子数少一个,且为短周期元素,其s电子总数为4、p电子总数为3,则Z为N元素;
M存在质量数为27、中子数为14的核素,则M质子数为13,所以M为Al元素;
W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色,则W为Fe元素,
(1)W为Fe元素,位于元素周期表第四周期第VIII族,基态原子核外有多少种能级就有多少种运动状态;
(2)元素的非金属性越强,其电负性越大,非金属性O;
同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
元素的非金属性越强,其气态氢化物越稳定;同一主族元素的氢化物中,其氢化物沸点随着相对分子质量的增大而增大,但含有氢键的物质沸点最高;
(3)Al、O形成的化合物Al
2O
3与N的最高价氧化物对应的水化物HNO
3反应生成盐和水;
(4)在500℃,30MPa下,将1molH
2与足量的N
2置于密闭容器中充分反应生成NH
3,H
2的转化率为25%时,氢气参加反应的物质的量=1mol×25%=0.25mol,放出热量为7.7kJ,3mol氢气完全反应放出的热量=
×3mol=92.4kJ.
解答:
解:X、Y、Z、W是元素周期表前四周期中的常见元素,
X的基态原子L层电子数是K层电子数的2倍,则L层电子数为4,则X是C元素;
Y形成的多种单质,其中之一是地球生物的“保护伞”臭氧,则Y是O元素;
Z的基态原子核外p能级总电子数比s能级总电子数少一个,且为短周期元素,其s电子总数为4、p电子总数为3,则Z为N元素;
M存在质量数为27、中子数为14的核素,则M质子数为13,所以M为Al元素;
W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色,则W为Fe元素,
(1)W为Fe元素,位于元素周期表第四周期第VIII族,基态原子核外有多少种能级就有多少种运动状态,基态Fe原子核外有8种能级,所以其基态原子核外有8种运动状态,故答案为:四;VIII;8;
(2)元素的非金属性越强,其电负性越大,非金属性O>C,所以电负性O>C;
同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,Z是N元素、Y是O元素,二者位于同一周期,N元素位于第VA族、O元素位于第VIA族,所以第一电离能N>O;
元素的非金属性越强,其气态氢化物越稳定,非金属性O>C,所以气态氢化物稳定性O>C,所以氢化物较稳定的是 H
2O;
同一主族元素的氢化物中,其氢化物沸点随着相对分子质量的增大而增大,但含有氢键的物质沸点最高,Y是O元素,氧族元素中,水的相对分子质量最小,但含有氢键导致其沸点最高,所以沸点最低的是H
2S,
故答案为:小;大;H
2O;H
2S;
(3)Al、O形成的化合物Al
2O
3与N的最高价氧化物对应的水化物HNO
3反应生成盐和水,反应方程式为Al
2O
3+6HNO
3=2Al(NO
3)
3+3H
2O,故答案为:Al
2O
3+6HNO
3=2Al(NO
3)
3+3H
2O;
(4)在500℃,30MPa下,将1molH
2与足量的N
2置于密闭容器中充分反应生成NH
3,H
2的转化率为25%时,氢气参加反应的物质的量=1mol×25%=0.25mol,放出热量为7.7kJ,3mol氢气完全反应放出的热量=
×3mol=92.4kJ,其热化学方程式为:N
2(g)+3H
2(g)═2NH
3(g)△H=-92.4kJ?mol
-1,故答案为:N
2(g)+3H
2(g)═2NH
3(g)△H=-92.4kJ?mol
-1.
点评:本题考查位置结构性质的相互关系及应用,涉及热化学反应方程式、氢键、电负性和电离能等知识点,侧重考查学生综合应用能力,氢键只影响物质物理性质不影响化学性质,氢键属于分子间作用力,知道第一电离能变化规律及异常现象,题目难度中等.



 教材全解字词句篇系列答案
教材全解字词句篇系列答案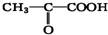 ),由以上事实推知乳酸的结构简式为
),由以上事实推知乳酸的结构简式为