
 ,其水溶液呈弱酸性,为弱电解质,电离出H+、HO2-,故W第一步电离方程式为H2O2?H++HO2-,
,其水溶液呈弱酸性,为弱电解质,电离出H+、HO2-,故W第一步电离方程式为H2O2?H++HO2-, ;H2O2?H++HO2-;
;H2O2?H++HO2-;

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
| A、铜溶于FeCl3溶液:Cu+Fe3+=Cu2++Fe2+ |
| B、Na[Al(OH)4]溶液中通入过量CO2:[Al(OH)4]-+CO2=Al(OH)3↓+CO32- |
| C、氯化铝溶液中加过量氨水:Al3++3OH-═Al(OH)3↓ |
| D、次氯酸钠溶液中滴入浓盐酸产生氯气:ClO-+Cl-+2H+=Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
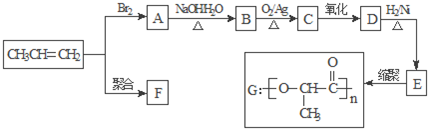
查看答案和解析>>
科目:高中化学 来源: 题型:
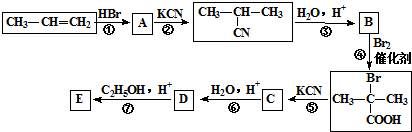
| H2O/H+ |
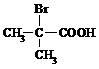 与足量NaOH溶液反应的化学方程式为
与足量NaOH溶液反应的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y形成的多种单质,其中之一是地球生物的“保护伞” |
| Z | Z的基态原子核外p能级总电子数比s能级总电子数少一个 |
| M | M存在质量数为27,中子数为14的核素 |
| W | W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、四种元素位于同一周期 |
| B、氢化物的稳定性H2Y>HZ |
| C、离子的氧化性aW3+>bX+ |
| D、原子半径Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使甲基橙变红的溶液中:Cr2O72-、Fe2+、SO42-、K+ |
| B、无色强酸性溶液中:Na+、Cl-、SO42-、[Cu(NH3)4]2+ |
| C、加入过量氨水溶液仍然澄清的溶液中:Cu2+、Ag+、NO3-、NH4+ |
| D、能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食醋(含CH3COOH)可以用来洗涤热水瓶胆中的污垢[含CaCO3、Mg(OH)2] |
| B、用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验 |
| C、用米汤检验食用加碘盐(含KIO3)中含有碘 |
| D、用灼烧方法鉴别纯毛线和棉布 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com