
【题目】在一定条件下,将A和B各0.32mol充入10L恒容密闭容器中,发生反应:
A(g)+B(g)![]() 2C(g) △H<0,反应过程中测定的数据如下表,下列说法正确的是
2C(g) △H<0,反应过程中测定的数据如下表,下列说法正确的是
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A. 反应前2 min的平均速率v(C)=0.004 mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v (逆)> v (正)
C. 其他条件不变,起始时向容器中充入0.64mol A和0.64mol B,平衡时n(C)<0.48mol
D. 其他条件不变,向平衡体系中再充入0.32mol A,再次平衡时,B的转化率增大
【答案】D
【解析】
试题前2 min的平均速率v(B)=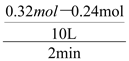 ="0.004" mol/(L·min),则v(C)=0.008 mol/(L·min),A错误;降低温度,平衡向右移动,达到新平衡前v (逆)<v (正),B错误;起始时向容器中充入0.64mol A和0.64mol B,相当于加压,使体积变成原来的一半,而加压时平衡不移动,但个物质的物质的量会变成原来的2倍,原平衡时n(B)=0.2mol,则n(C)=2×(0.32mol—0.2mol)=0.24mol,因此新平衡时n(C)=0.48mol,C错误;向平衡体系中再充入0.32mol A,平衡向右移动,B的转化率增大,D正确。
="0.004" mol/(L·min),则v(C)=0.008 mol/(L·min),A错误;降低温度,平衡向右移动,达到新平衡前v (逆)<v (正),B错误;起始时向容器中充入0.64mol A和0.64mol B,相当于加压,使体积变成原来的一半,而加压时平衡不移动,但个物质的物质的量会变成原来的2倍,原平衡时n(B)=0.2mol,则n(C)=2×(0.32mol—0.2mol)=0.24mol,因此新平衡时n(C)=0.48mol,C错误;向平衡体系中再充入0.32mol A,平衡向右移动,B的转化率增大,D正确。


 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】在常温下,用0.1000 mol/L的盐酸滴定25 mL 0.1000 mol/L Na2CO3溶液,所得滴定曲线如下图所示。下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是
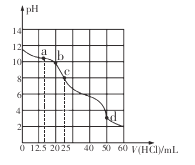
A. a点:c( HCO3-)>c(Cl-)>c(C032-)
B. b点:c(Na+)+c(H+)=c(Cl一)+c(HCO3-)+c(CO32-)+c(OH-)
C. c点:c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
D. d点:c(Cl-)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 标况下,224 L H2O含有的分子数为10NA
B. 1 mol任何气体所含的原子数均为NA
C. 28 g CO所含的分子数为NA
D. 标况下,NA个分子的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下, 0.1 mol/L的某二元酸 H2A 溶液中,可能存在的所有含 A 粒子的物质的量分数随pH 变化的关系如图所示。下列说法正确的是

A. H2A 的电离方程式:H2A![]() H+ + HA-
H+ + HA-
B. pH = 5 时,在NaHA和Na2A的混合溶液中: c(HA-) : c(A2-)= 1 : 100
C. 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. NaHA溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】起固氮作用的化学反应的是
A. 工业上用氮气和氢气合成氨气B. 一氧化氮与氧气反应生成二氧化氮
C. 氨气经催化氧化生成一氧化氮D. 由氨气制碳酸氢铵和硫酸铵
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的如上图所示.由图可得出的正确结论是( )
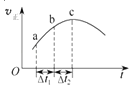
A.反应物的总能量低于生成物的总能量
B.反应物浓度:a点小于b点
C.△t1=△t2时,SO2的转化率:a~b段小于b~c段
D.反应在c点达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是

A. 含有大量SO42-的溶液中肯定不存在Ag+
B. Ag2SO4的溶度积常数(Ksp)为1×10-3
C. 0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
D. a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2,试回答:
(1)反应中氧化剂和还原剂的物质的量之比是_____;
(2)当转移1 mol电子时,被氧化的Cl2的物质的量是___;
(3)每产生1 mol O2时,被氧元素还原的Cl2的物质的量是_____;
(4)反应消耗的水是(_____)
A.全部被氧化 B.全部被还原 C.![]() 被氧化 D.
被氧化 D.![]() 被还原
被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图,其中反应Ⅲ制取ClO2的化学方程式为2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O。

(1)试剂X是________(填化学式);操作A的名称是________。
(2)分析上述流程,写出反应Ⅱ的化学方程式:________________________________。
(3)用ClO2处理过的饮用水常含有一定量有害的ClO2-。我国规定饮用水中ClO2-的含量应不超过0.2 mg·L-1。测定水样中ClO2、ClO2-的含量的过程如下:
①量取20 mL水样加入到锥形瓶中,并调节水样的pH为7.0~8.0。
②加入足量的KI晶体。此过程发生反应2ClO2+2I-=2 ClO2-+I2。
③加入少量淀粉溶液,再向上述溶液中滴加1×10-3 mol·L-1 Na2S2O3溶液至溶液蓝色刚好褪去,消耗Na2S2O3溶液5.960 mL。此过程发生反应:2S2O32-+I2=S4O62-+2I-。
④调节溶液的pH≤2.0,此过程发生反应ClO2-+4H++4I-=Cl-+2I2+2H2O。
⑤再向溶液中滴加1×10-3 mol·L-1 Na2S2O3溶液至蓝色刚好褪去,消耗Na2S2O3溶液24.00 mL。根据上述数据计算并判断该水样中ClO2-的含量是否超过国家规定____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com