
| 1 |
| 2 |
| 1 |
| 2 |
| A、9.1% | B、10.0% |
| C、28.6% | D、71.5% |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 10 |
| 1 |
| 10 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 10 |
| 1 |
| 2 |
| 1 |
| 2 |
| x |
| 2 |
| x |
| 2 |
| x |
| 2 |
| x |
| 2 |
(
| ||||||||
| 1-x |
| 1 |
| 10 |
| 0.17 |
| 1.0 |


科目:高中化学 来源: 题型:
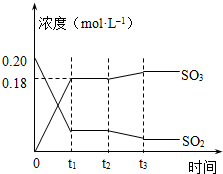 已知2SO2 (g)+O2(g)?2SO3(g)△H=-196kJ?mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡.如图所示:
已知2SO2 (g)+O2(g)?2SO3(g)△H=-196kJ?mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡.如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | ||
| B、醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→Cu2++2CH3COO-+2H2O | ||
C、苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O
| ||
D、甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素原子半径大小呈周期性变化 |
| B、元素原子最外层电子排布呈周期性变化 |
| C、元素原子量依次递增 |
| D、元素的最高正化合价呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A、b点表示的溶液中c(CH3COO-)>c(Na+) | ||
| B、c点表示CH3COOH和NaOH恰好反应完全 | ||
| C、a、b点间一定存在c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | ||
D、b、d点表示的溶液中
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com