
【题目】现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。
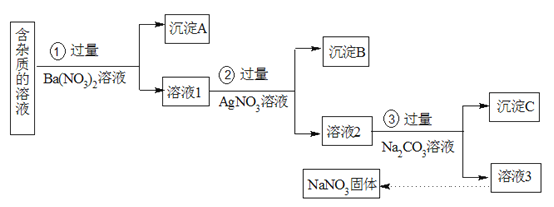
(1)沉淀A的主要成分是_________(填化学式)。
(2)②中反应的离子方程式是_________。
(3)③加入过量的Na2CO3溶液的目的是________。
(4)溶液3中肯定含有的杂质是_______,为除去杂质可向溶液3中加入过量的_______。
【答案】BaSO4、BaCO3 Cl-+Ag+=AgCl↓ 除去过量的Ba2+和Ag+ Na2CO3或CO32 稀硝酸
【解析】
由实验流程可知,在含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液中加入过量的Ba(NO3)2,反应生成BaSO4、BaCO3沉淀,过量得到的沉淀A中含有BaSO4、BaCO3;然后在溶液1中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,则沉淀B为AgCl;在溶液2中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液3为NaNO3和Na2CO3的混合溶液,可以加入稀HNO3,再蒸发得固体NaNO3,据此分析解答。
(1)根据上述分析,加入过量的Ba(NO3)2,Na2SO4、Na2CO3和Ba(NO3)2反应生成BaSO4、BaCO3沉淀,沉淀A的主要成分是BaSO4、BaCO3,故答案为:BaSO4、BaCO3;
(2)溶液1中含氯离子,加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,反应的离子方程式为:Ag++Cl-═AgCl↓,故答案为:Ag++Cl-═AgCl↓;
(3)在所得溶液2中含有Ag+、Ba2+,在所得滤液中加入过量的Na2CO3,能够使溶液中的Ag+、Ba2+完全沉淀除去,故答案为:除去过量的Ba2+和Ag+;
(4)根据上述分析,溶液3为NaNO3和Na2CO3的混合溶液,含有的杂质为过量的Na2CO3,可以加入稀HNO3除去Na2CO3,经过蒸发浓缩、冷却结晶、过滤得到硝酸钠固体,故答案为:Na2CO3;HNO3。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】A、B和C为常见气体,A是所有气体中密度最小的气体;B是黄绿色气体;C能使湿润的红色石蕊试纸变蓝。D是目前用量最大,用途最广的金属。请回答下列问题:
(1)A是________(填化学式)
(2)实验室制取C时,常用________(填“向下”或“向上”)排空气法收集;
(3)B与D的单质在点燃条件下反应的化学方程式为______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)基态Co2+的核外电子排布式为____。
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中1 mol Fe(CO)5含有____mol配位键,图2中C原子的杂化方式为____,形成上述两种化合物的四种元素中电负性最大的是____(填元素符号)。
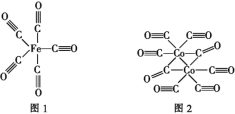
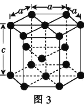
(3)金属钴的堆积方式为六方最密堆积,其配位数是____,钴晶体晶胞结构如图3所示,该晶胞中原子个数为____;该晶胞的边长为a nm,高为c nm,该晶胞的密度为____(NA表示阿伏加德罗常数的值,列出代数式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素![]() 的原子序数依次增大,其中
的原子序数依次增大,其中![]() 位于同一主族。
位于同一主族。![]() 的气态氢化物常用作制冷剂。
的气态氢化物常用作制冷剂。![]() 与水剧烈反应,可观察到液面上有白雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色。下列说法正确的是( )
与水剧烈反应,可观察到液面上有白雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色。下列说法正确的是( )
A.最简单氢化物的沸点:![]()
B.原子半径:![]()
C.把![]() 通入石蕊试液中,石蕊先变红后褪色
通入石蕊试液中,石蕊先变红后褪色
D.向![]() 与水反应后的溶液中滴加
与水反应后的溶液中滴加![]() 溶液有白色沉淀生成
溶液有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如右图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。请回答下列问题:
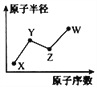
(1)写出四种元素的元素符号:X____ Y____ Z____ W____
(2)HYO3的酸性比HWO强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确___,说明理由__________________________________。
(3)甲和乙分别是由W、X、Y、Z四种元素中的三种元素组成的常见化合物,化合物甲具有漂白消毒杀菌作用,其化学式为________;化合物乙是一种常见的强酸,会因保存不当而变成黄色液体,其原因是_______________________________。把红热的木炭投入黄色液体,剧烈反应,方程式为_____________________,将产生的气体通过澄清石灰水时气体变为无色,但未见有浑浊现象,原因是______________。(写出有关反应的化学方程式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是

A. e、f两管中的试剂可以分别是浓氨水和NaOH固体
B. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷和镍均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。与砷同周期的主族元素的基态原子中,第一电离能最大的为_____________(填元素符号。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为__________________________。
②Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3) 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含![]() 键和π键的数目之比为___________。
键和π键的数目之比为___________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B. 1 mol金刚石晶体中,平均含有2 mol C—C键
C. 水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键
D. 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE
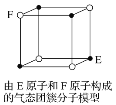
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g)![]() cQ(g)。气体M、N、Q的物质的量随时间的变化如右图所示,则下列叙述正确的是( )
cQ(g)。气体M、N、Q的物质的量随时间的变化如右图所示,则下列叙述正确的是( )

A. 体系平衡时与反应起始时的压强之比为3∶2
B. 平衡时,M的转化率为50%,若条件改为恒温恒压,则达平衡时M的转化率小于50%
C. 若开始时向容器中充入2 mol M和1 mol N,达到平衡时,M的体积分数小于50%
D. 在5 min时,再向体系中充入少量He,重新达到平衡前v(正)>v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com