
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)基态Co2+的核外电子排布式为____。
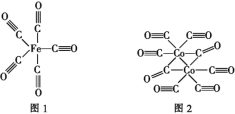
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中1 mol Fe(CO)5含有____mol配位键,图2中C原子的杂化方式为____,形成上述两种化合物的四种元素中电负性最大的是____(填元素符号)。
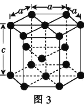
(3)金属钴的堆积方式为六方最密堆积,其配位数是____,钴晶体晶胞结构如图3所示,该晶胞中原子个数为____;该晶胞的边长为a nm,高为c nm,该晶胞的密度为____(NA表示阿伏加德罗常数的值,列出代数式)g·cm-3。
【答案】[Ar]3d7或1s22s22p63s23p63d7 10 sp、sp2 O 12 6 ![]()
【解析】
(1)Co为27号元素,Co2+的核外电子数为25,根据构造原理书写核外电子排布式;
(2)1molFe(CO)5中Fe原子与5个CO形成5个配位键,在每个CO分子中存在1个配位键;Co2(CO)8中含有碳氧双键和碳氧三键;元素的非金属性越强,电负性越大;
(3)由金属钴的堆积方式为六方最密堆积可知配位数为12;由晶胞结构可知,钴原子有12个位于顶点、2个位于面心、3个位于体内,由均摊法确定原子个数和计算晶体密度。
(1)Co为27号元素,Co2+的核外电子数为25,根据构造原理可知核外电子排布式为:1s22s22p63s23p63d7,故答案为:1s22s22p63s23p63d7;
(2)1molFe(CO)5中Fe原子与5个CO形成5个配位键,在每个CO分子中存在1个配位键,共含有10mol配位键;由图可知,Co2(CO)8中含有碳氧双键和碳氧三键,双键中C原子的杂化方式为sp2杂化,三键中C原子的杂化方式为sp杂化;元素的非金属性越强,电负性越大,O元素非金属性最强,则电负性最大的是O元素,故答案为:10; sp、sp2;O;
(3)由金属钴的堆积方式为六方最密堆积可知配位数为12;由晶胞结构可知,钴原子个数为12×![]() +2×
+2×![]() +3=6;由晶胞的边长为a nm,高为c nm可知晶报的体积为
+3=6;由晶胞的边长为a nm,高为c nm可知晶报的体积为![]() ×a×10—7cm×
×a×10—7cm×![]() ×a×10—7cm×c×10—7cm×6=
×a×10—7cm×c×10—7cm×6=![]() ×10—21a2ccm3,则晶胞的密度为
×10—21a2ccm3,则晶胞的密度为![]() =
=![]() g·cm-3,故答案为:12;6;
g·cm-3,故答案为:12;6;![]() 。
。


科目:高中化学 来源: 题型:
【题目】锂离子电池的正极材料是含锂的钴酸锂(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,用LiC6表示。电池反应为CoO2+LiC6![]() LiCoO2+C6,下列说法正确的是( )
LiCoO2+C6,下列说法正确的是( )
A.充电时,电池的负极反应为LiC6-e-=Li++C6
B.放电时,电池的正极反应为CoO2+Li++e-=LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[Fe(C5H5)2]可作为燃料的节能消烟剂、抗爆剂。二茂铁的电化学制备装置与原理如图所示,下列说法正确的是
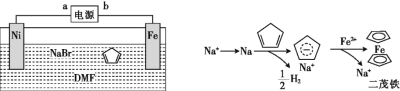
A.a为电源的负极
B.电解质溶液是NaBr水溶液和DMF溶液的混合液
C.电解池的总反应化学方程式为Fe+2C5H6![]() Fe(C5H5)2+H2↑
Fe(C5H5)2+H2↑
D.二茂铁制备过程中阴极的电极反应为2H++2e-![]() H2 ↑
H2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
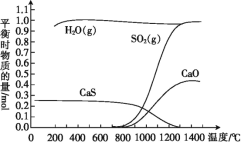
【题目】氢气还原石膏的过程会发生多个反应,其中主要反应为Ⅰ、Ⅱ、Ⅲ,当CaSO4(s)与H2(g)的起始物质的量之比为1∶1时,测得平衡时物质的量如图所示。
Ⅰ:CaSO4(s)+H2(g)![]() CaO(s)+H2O(g)+SO2(g) ΔH1>0
CaO(s)+H2O(g)+SO2(g) ΔH1>0
Ⅱ:CaSO4(s)+4H2(g)![]() CaS(s)+4H2O(g) ΔH2<0
CaS(s)+4H2O(g) ΔH2<0
Ⅲ:3CaSO4(s)+CaS(s)![]() 4CaO(s)+4SO2(g) ΔH3
4CaO(s)+4SO2(g) ΔH3
回答下列问题:
(1)100 ℃~700 ℃主要发生反应____(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)ΔH3=____(用含ΔH1、ΔH2的代数式表示),ΔH3____(填“>”或“<”)0,反应Ⅲ达到平衡后,升高温度,平衡____(填“正向”或“逆向”)移动。
(3)向某恒温恒容密闭容器中加入0.3 mol CaSO4和0.1 mol CaS,高温下若只发生反应Ⅲ,达到平衡时向容器中再充入少量SO2,下列说法正确的是____(填字母)。
A.重新平衡时,容器内气体总压强增大
B.重新平衡时,CaO的量减少
C.重新平衡时,SO2的浓度不变
D.CaSO4(s)、CaS(s)的质量不变
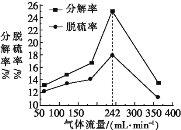
(4)其他条件一定时,H2的流量与石膏的分解率和脱硫率关系如图所示。在气体流量高于242 mL·min-1时,分解率和脱硫率均降低,可能的原因是____(只写一条)。
(5)已知其中副反应之一为2CaSO4(s)![]() 2CaO(s)+2SO2(g)+O2(g),在1625 K时,平衡常数Kp=1.45×10-5 atm3(atm表示大气压,
2CaO(s)+2SO2(g)+O2(g),在1625 K时,平衡常数Kp=1.45×10-5 atm3(atm表示大气压,![]() ≈3.81)。该温度下,反应CaO(s)+SO2(g)+
≈3.81)。该温度下,反应CaO(s)+SO2(g)+![]() O2(g)
O2(g) ![]() CaSO4(s)的K'p=____(保留整数部分)。
CaSO4(s)的K'p=____(保留整数部分)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液![]() 中,可能含有
中,可能含有![]() 中的一种或几种。现取该溶液适量,向其中加入一定物质的量浓度的稀盐酸,产生沉淀的物质的量(n)与加入盐酸的体积(V)的关系如图所示。下列说法中不正确的是( )
中的一种或几种。现取该溶液适量,向其中加入一定物质的量浓度的稀盐酸,产生沉淀的物质的量(n)与加入盐酸的体积(V)的关系如图所示。下列说法中不正确的是( )
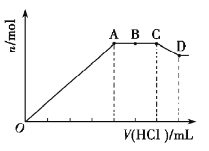
A.溶液![]() 中一定不含
中一定不含![]() ,可能含有
,可能含有![]()
B.![]() 段参加反应的阴离子的物质的量之比为
段参加反应的阴离子的物质的量之比为![]() 或
或![]()
C.![]() 段一定生成了气态物质
段一定生成了气态物质
D.![]() 段发生反应的离子方程式为:
段发生反应的离子方程式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的衍生物W,仅含C、H、O三种元素.测其密度是相同条件下H2的45倍,各元素的质量百分含量如下表:
C% | H% | O% |
40.00% | 6.67% | 53.33% |
已知,W既能与乙酸反应,又能与乙醇反应,生成物都是酯和水。W的核磁共振氢谱图中有四种吸收峰,面积之比为3:1:1:1。
求:(1)W的相对分子质量为___;
(2)试计算确定W的分子式:___;
(3)W的结构简式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。
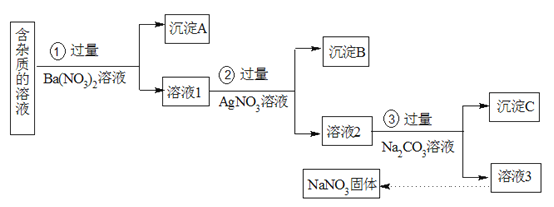
(1)沉淀A的主要成分是_________(填化学式)。
(2)②中反应的离子方程式是_________。
(3)③加入过量的Na2CO3溶液的目的是________。
(4)溶液3中肯定含有的杂质是_______,为除去杂质可向溶液3中加入过量的_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)Na2O2的电子式为___________。它与水反应的离子方程式是__________________。
(2)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在;取少量溶液a,加入试剂___________(填化学式),有气体产生。
(3)乙同学查阅资料获悉:用KMnO4可以氧化H2O2并测定其含量。取20.00mL溶液,用稀H2SO4酸化,用0.002mol/L KMnO4溶液滴定,产生气体,溶液褪色,至终点时共消耗10.00mL KMnO4溶液。
①实验中,滴定时KMnO4溶液应装在__________(酸或碱)式滴定管中。
②用单线桥标出该反应电子转移的方向和数目:_______________。
2MnO4-+5H2O2+6H+ = 2Mn2++5O2↑+8H2O。
③溶液a中 c(H2O2)=___________ mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com