
【题目】某学习小组通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)Na2O2的电子式为___________。它与水反应的离子方程式是__________________。
(2)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在;取少量溶液a,加入试剂___________(填化学式),有气体产生。
(3)乙同学查阅资料获悉:用KMnO4可以氧化H2O2并测定其含量。取20.00mL溶液,用稀H2SO4酸化,用0.002mol/L KMnO4溶液滴定,产生气体,溶液褪色,至终点时共消耗10.00mL KMnO4溶液。
①实验中,滴定时KMnO4溶液应装在__________(酸或碱)式滴定管中。
②用单线桥标出该反应电子转移的方向和数目:_______________。
2MnO4-+5H2O2+6H+ = 2Mn2++5O2↑+8H2O。
③溶液a中 c(H2O2)=___________ mol/L。
【答案】 ![]() 2Na2O2 + 2H2O = 4Na++4OH- + O2↑ MnO2(Cu2+、Fe3+也可) 酸
2Na2O2 + 2H2O = 4Na++4OH- + O2↑ MnO2(Cu2+、Fe3+也可) 酸 ![]() 0.0025
0.0025
【解析】试题分析:本题考查Na2O2与水反应的探究,氧化还原滴定实验,单线桥表示氧化还原反应。
(1)Na2O2的电子式为![]() 。Na2O2与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑。
。Na2O2与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑。
(2)要检验溶液a中存在H2O2,可向溶液中加入催化剂如MnO2(或Fe3+、Cu2+),若产生气体则证明含H2O2。
(3)①KMnO4溶液具有强氧化性,能腐蚀橡胶管,不能装在碱式滴定管中,KMnO4溶液应装在酸式滴定管中。
②在KMnO4溶液与H2O2的反应中,Mn元素的化合价由MnO4-中的+7价降至Mn2+中的+2价,H2O2中O元素的化合价由-1价升高到O2中的0价,用单线桥表示为![]() 。
。
③n(KMnO4)=0.002mol/L![]() 0.01L=2
0.01L=2![]() 10-5mol,根据关系式2KMnO4~5H2O2,n(H2O2)=
10-5mol,根据关系式2KMnO4~5H2O2,n(H2O2)=![]() n(KMnO4)=5
n(KMnO4)=5![]() 10-5mol,溶液a中c(H2O2)=5
10-5mol,溶液a中c(H2O2)=5![]() 10-5mol
10-5mol![]() 0.02L=0.0025mol/L。
0.02L=0.0025mol/L。


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】阿托酸乙酯可用于辅助治疗胃肠道痉挛及溃疡。阿托酸乙酯的一种合成路线如下图所示:
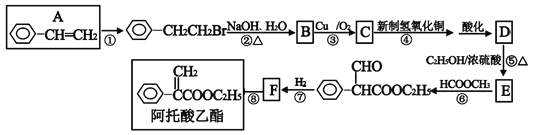
请回答下列问题:
(1)A的名称是__________,阿托酸乙酯所含官能团的名称____________。
(2)反应⑥的反应类型为______________;F的结构简式____________。
(3)反应③的方程式______________________________________。反应⑤的方程式______________________________________。
(4)有关阿托酸乙酯的说法正确的是____________。
A.1mol阿托酸乙酯最多能与4molH2加成
B.能使酸性高锰酸钾褪色,也能使溴水褪色
C.能发生加成、加聚、氧化、水解等反应
D.分子式为C11H13O2
(5)D的同分异构体有多种,符合含有苯环且能与碳酸氢钠反应放出气体的同分异构体有_________种(不包含D)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如下表所示:
,在不同的温度下该反应的平衡常数如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 如果在一定体积的密闭容器中加入CO2和H2各1mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
D. 某温度下,如果平衡浓度符合下列关系式: ![]() =
=![]() ,判断此时的温度是1000℃
,判断此时的温度是1000℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金是当前广泛应用的材料,请写出建筑材料中常用的一种用来封阳台和做门窗的合金材料_____________。自行车轮胎的材料是__________,请比较自行车在干燥环境和潮湿环境生锈的相对程度______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
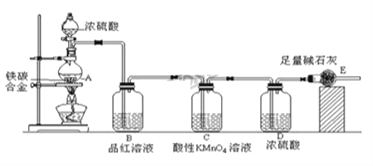
(1)mg铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
① 常温下碳与浓硫酸不反应;②________________________。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程____________________________。
(3)B中的现象是:_______________________;C的作用是:___________________。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg.则铁碳合金中铁的质量分数为________________(写表达式)。
(5)甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
A. 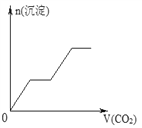 B.
B. 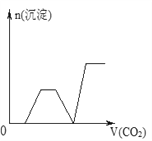
C. 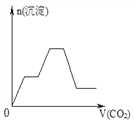 D.
D. 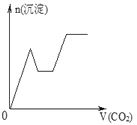
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大。元素A、B、C、D、E的原子结构等信息如下:
元素 | 元素性质或原子结构 |
A | 周期表中原子半径最小的元素 |
B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
C | 最外层p轨道半充满 |
D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
E | 位于ds区且原子的最外层电子数与A的相同 |
请回答下列问题(用A、B、C、D、E所对应的元素符号作答):
(1)B、C、D第一电离能由小到大为______________。
(2)E的二价离子的电子排布式为_____________。
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为_____________;1 mol A2B2D4分子中含有σ键数目为_____________。
(4)与化合物BD互为等电子体的阴离子化学式为___________ (任写一种)。
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是_______________。
(6)BD2在高温高压下所形成晶体的晶胞如图所示。一个该晶胞中含___________个D原子。
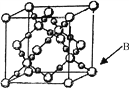
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Pauling的杂化轨道理论解释甲烷分子的四面体结构,下列说法不正确的是( )
A.C原子的四个杂化轨道的能量一样
B.C原子的sp3杂化轨道之间夹角一样
C.C原子的4个价电子分别占据4个sp3杂化轨道
D.C原子有1个sp3杂化轨道由孤对电子占据
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出CH3CH=CHCH3这种烯烃的顺、反异构体的结构简式:________、__________。
(2)有下列五种烃:① ![]() ②
②![]() ③乙烷 ④正戊烷 ⑤
③乙烷 ④正戊烷 ⑤ ![]() ⑥
⑥![]() ,其中② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是______________(填序号),等质量的①③⑥三种物质,完全燃烧时消耗O2的物质的量由多到少的顺序为_________。
,其中② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是______________(填序号),等质量的①③⑥三种物质,完全燃烧时消耗O2的物质的量由多到少的顺序为_________。
(3)某芳香烃的分子式为C8H10,它可能有的同分异构体共 ____________________种,其中_________________________(结构简式)在苯环上的一溴代物只有两种
(4)有机物M分子式为C4H8O3,同温同压下,等质量的M分别与足量的金属钠、NaHCO3溶液反应,可得到等量的气体;在浓硫酸存在下,M还能生成一种分子式为C4H6O2的五元环状化合物N。根据上述性质,确定C4H8O3的结构简式为________________,写出M→N对应的化学方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com