
����Ŀ��ijУ��ѧ��ȤС�������ͼʾʵ��װ�ã�ͼ��ʡ���˼г����������ⶨij��̼�Ͻ�����������������
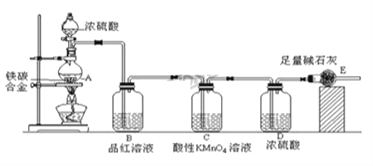
��1��mg��̼�Ͻ��м������Ũ���ᣬδ��ȼ�ƾ���ǰ��A��B��������������ԭ���ǣ�
�� ������̼��Ũ�����Ӧ����________________________��
��2��д������ʱA��̼��Ũ���ᷢ����Ӧ�Ļ�ѧ����____________________________��
��3��B�е������ǣ�_______________________��C�������ǣ�___________________��
��4����A�в����ݳ�����ʱ��ֹͣ���ȣ�����E�����أ�E����bg������̼�Ͻ���������������Ϊ________________��д����ʽ����
��5����ͬѧ��Ϊ���ô�װ�ò��������������ƫ������д�����ܵ�ԭ��_____________________��
���𰸡� ������Fe��Ũ���ᷢ���ۻ� C+2H2SO4��Ũ��![]() CO2��+2SO2��+2H2O Ʒ����Һ��ɫ ������Ӧ�����е�SO2����
CO2��+2SO2��+2H2O Ʒ����Һ��ɫ ������Ӧ�����е�SO2���� ![]() ��100% װ���ڵ�CO2���ԸϾ�������E��������ƫС
��100% װ���ڵ�CO2���ԸϾ�������E��������ƫС
��������(1)�����£�����Ũ���ᷴӦ����һ�����ܵ������ﱣ��Ĥ����ֹ�ڽ���������Ũ���ᷴӦ�������ۻ����ʴ�Ϊ��������Fe��Ũ���ᷢ���ۻ���
(2)̼��Ũ�����ڼ��ȵ����������ɶ�����������̼��ˮ����Ӧ����ʽΪC+2H2SO4(Ũ)![]() CO2��+2SO2��+2H2O���ʴ�Ϊ��C+2H2SO4(Ũ)
CO2��+2SO2��+2H2O���ʴ�Ϊ��C+2H2SO4(Ũ)![]() CO2��+2SO2��+2H2O��
CO2��+2SO2��+2H2O��
(3)A�����ɵ����庬��CO2��SO2��SO2����Ư���ԣ���ʹƷ����Һ��ɫ��Cװ�õ�����Ϊ������Ӧ�����е�SO2���壬��ֹӰ�������̼�������ⶨ���ʴ�Ϊ��Ʒ����Һ��ɫ��������Ӧ�����е�SO2���壻
(4)E����b gΪ������̼������������̼Ԫ���غ��֪�Ͻ���̼Ԫ�ص�����Ϊ![]() bg���Ͻ�����������Ϊmg-
bg���Ͻ�����������Ϊmg-![]() bg=(m-
bg=(m-![]() b)g����������������
b)g����������������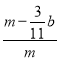 =
=![]() ���ʴ�Ϊ��
���ʴ�Ϊ�� ![]() ��
��
(5)װ���ڲ������ֶ�����̼��δ�ܱ�װ��E��ȫ���գ����²����Ķ�����̼������ƫС�����Ͻ���̼Ԫ�ص�����ƫС����Ԫ�ص��������������������ʴ�Ϊ��װ���ڵ�CO2���ԸϾ�������E��������ƫС��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʳƷ���Ӽ�������Ӧ��ȷ��һ����
A. ��ɫ��_______��������
B. ���_______��������
C. Ӫ��ǿ����_______��ʳ��Ʒ�м�������
D. ������_______�Ȳ˺�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ӧ����Cl2 +FeI2 =FeCl2 +I2 ��2Fe2+ +Br2 =2Fe3+ +2Br�� ��Co2O3 +6HCl=2CoCl2 +Cl2��+3H2 O����˵����ȷ����
A. �٢ڢ��е���������ֱ���I2 ��Fe3+ ��CoCl2
B. �������Ϸ���ʽ���Եõ�������Cl2 >Fe3+ >Co2O3
C. �ڢ۷�Ӧ�е�1molCo2O3 �μӷ�Ӧʱ��2molHCl������
D. ���������õ�Cl2 +FeBr2 =FeCl2 +Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X����Һ�У�����Y�Լ��������ij�����������ͼ��ʾ����������������ǣ� �� 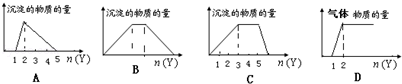
A.��HCl��AlCl3�Ļ��Һ�еμ�NaOH
B.��NaOH��Ca��OH��2�Ļ��Һ��ͨ��CO2
C.��NH4Al��SO4��2��Һ�еμ�NaOH
D.��NaOH��Na2CO3�Ļ��Һ�еμ�ϡHCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĶ��������У������и������ٷ����仯ʱ��������ӦA��g��+2B��g�� ![]() C��g��+D��g���Ѵﵽƽ��״̬������ ��
C��g��+D��g���Ѵﵽƽ��״̬������ ��
����������ѹǿ�����������ܶ���B�����ʵ���Ũ�����������������ʵ�������������ƽ����Է���������v��C����v��D���ı�ֵ���������������������������������C��D�ķ�����֮��Ϊ1��1
A���٢ڢۢܢݢޢߢ� B���٢ۢܢݢ�� C���٢ڢۢܢݢ� D���٢ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��ͨ��ʵ���о�Na2O2��ˮ�ķ�Ӧ��
���� | ���� |
��ʢ��4.0g Na2O2���ձ��м���50mL����ˮ | ���ҷ�Ӧ��������ʹ������ľ����ȼ�����壬�õ�����ɫ��Һa |
����Һa�е������η�̪ | ������Һ��� ����10���Ӻ���Һ��ɫ���Ա�dz���Ժ���Һ��Ϊ��ɫ |
��1��Na2O2�ĵ���ʽΪ___________������ˮ��Ӧ�����ӷ���ʽ��__________________��
��2����ͬѧ��Ϊ������Һ��ɫ����Һa�д��ڽ϶��H2O2��H2O2���̪�����˷�Ӧ����ʵ��֤ʵ��H2O2�Ĵ��ڣ�ȡ������Һa�������Լ�___________���ѧʽ���������������
��3����ͬѧ�������ϻ�Ϥ����KMnO4��������H2O2���ⶨ�京����ȡ20.00mL��Һ����ϡH2SO4�ữ����0.002mol/L KMnO4��Һ�ζ����������壬��Һ��ɫ�����յ�ʱ������10.00mL KMnO4��Һ��
��ʵ���У��ζ�ʱKMnO4��ҺӦװ��__________�����ʽ�ζ����С�
��������������÷�Ӧ����ת�Ƶķ������Ŀ��_______________��
2MnO4-+5H2O2+6H+ = 2Mn2++5O2��+8H2O��
����Һa�� c(H2O2)=___________ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������п����ϡ������ȡH2�����д�ʩ��ʹ��Ӧ���ʼ�������
A. ��ϡ�����м�ˮ B. ����п������ C. ��п�۴���п�� D. ���߷�Ӧ�¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ijЩ���ӵļ��鼰����һ����ȷ����
A. ����ϡ���������ɫ���壬������ͨ�����ʯ��ˮ�У���Һ����ǣ�һ����CO![]()
B. �����Ȼ�����Һ�а�ɫ�����������ټ����ᣬ��������ʧ��һ����SO![]()
C. ��������������Һ�����ȣ�������������ʹʪ��ĺ�ɫʯ����ֽ������һ����NH![]()
D. ����̼������Һ������ɫ�������ټ������ɫ������ʧ��һ����Ba2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧΪ̽��Ԫ�����ڱ���Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�飮
��1�����ơ�þ������1 mol�ֱ�Ͷ�뵽����ͬŨ�ȵ������У���Ԥ��ʵ�����������ᷴӦ����ң������ᷴӦ������������ࣨ�����ƣ���
��2����Na2S��Һ��ͨ���������ֻ�ɫ���ǣ���֤��Cl�ķǽ����Ա�Sǿ����Ӧ�����ӷ���ʽΪ��
��3����������ͼװ�ÿ���֤ͬ����Ԫ�طǽ����Եı仯���� 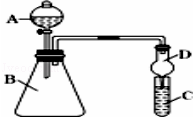
����A������Ϊ �� �����D������Ϊ ��
��4����Ҫ֤���ǽ����ԣ�Cl��I����A�м�Ũ���ᣬB�м�KMnO4��KMnO4��Ũ���᳣���·�Ӧ������������C�мӵ��۩��⻯�ػ����Һ���۲쵽C����Һ��������֤�����ӻ��������Ĺ۵㿼�ǣ���װ��ȱ��β������װ�ã�������Һ����β���������շ�Ӧ�����ӷ���ʽ��
��5����Ҫ֤���ǽ����ԣ�C��Si������A�м����ᡢB�м�CaCO3��C�м�Na2SiO3��Һ���۲쵽C����Һ��������֤�������е�ͬѧ��Ϊ������лӷ��ԣ��ɽ���C �и������飬Ӧ����װ�ü�����װ����Һ��ϴ��ƿ��ȥ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com