
����Ŀ���ҹ��ӹ������ijԭ�Ͼ��ⶨ��Ҫ����A��B��C��D��E����ǰ������Ԫ�أ���ԭ��������������Ԫ��A��B��C��D��E��ԭ�ӽṹ����Ϣ���£�
Ԫ�� | Ԫ�����ʻ�ԭ�ӽṹ |
A | ���ڱ���ԭ�Ӱ뾶��С��Ԫ�� |
B | ԭ�Ӻ��������ֲ�ͬ���ܼ��Ҹ����ܼ������ĵ�������ͬ |
C | �����p�������� |
D | λ�ڶ����ڣ���ԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3�� |
E | λ��ds����ԭ�ӵ�������������A����ͬ |
��ش���������(��A��B��C��D��E����Ӧ��Ԫ�ط�������)��
��1��B��C��D��һ��������С����Ϊ______________��
��2��E�Ķ������ӵĵ����Ų�ʽΪ_____________��
��3��A2B2D4��������������÷�����B���ӻ���ʽΪ_____________��1 mol A2B2D4�����к���������ĿΪ_____________��
��4���뻯����BD��Ϊ�ȵ�����������ӻ�ѧʽΪ___________ (��дһ��)��
��5��B2A6��C2A4�����о�����18�����ӣ����ǵķе����ϴ���Ҫԭ����_______________��
��6��BD2�ڸ��¸�ѹ�����γɾ���ľ�����ͼ��ʾ��һ���þ����к�___________��Dԭ�ӡ�
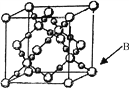
���𰸡� C��O��N [Ar]3d9 sp2 7 mol��7��6.02��1023�� CN����C22�� N2H4���Ӽ������� 16
���������������������Ԫ����Ԫ��A�����ڱ��а뾶��С������Ϊ��Ԫ�أ�BԪ��ԭ�Ӻ��������ֲ�ͬ��������ԭ�ӹ���Ҹ�����������ĵ�������ͬ����������Ų�Ϊ1s22s22p2����Ԫ��Ϊ̼��DΪλ�ڶ����ڣ���ԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3������������ԭ�ӵ����Ӵ���p�ܼ������3��������ɶԵ�������ֻ��Ϊ6����������Ϊ2��������Ų�Ϊ1s22s22p4����Ϊ��Ԫ�ء�CԪ��ԭ�������p����������ԭ������С��������Ϊ��Ԫ�ء�EΪds������ԭ�ӵ�������������A��ͬ����Χ�����Ų�Ϊ3d104s1����Ϊͭ����1��ͬ��������ԭ����������һ�����ܳ��������ƣ����ǵ�Ԫ��2p�ܼ�����3������Ϊ������ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ���ڵ�����Ԫ�أ����Ե�һ������˳��Ϊ��C<O<N����2��ͭ���ӵĵ����Ų�Ϊ1s22s22p63s23p63d9���� [Ar]3d9 �� ��3��H2C2O4���ó�������ṹ��ʽΪHOOC-COOH��������̼ԭ���γ�3��������û�й¶Ե��Ӷԣ��ø�����̼ԭ�ӵ��ӻ���ʽΪsp2������Ϊ������1����������HOOC-COOH�����к���7����������7 NA �� ��4��ԭ��������ͬ���۵���������ͬ����Ϊ�ȵ����壬�뻯����COΪ�ȵ������������CN����C22-��5��C2H6��N2H4�����о�����18�����ӣ����ǵķе����ϴ���Ҫԭ��ΪN2H4���Ӽ��������� ��6��������̼�ڸ��¸�ѹ���γɾ����к�ɫ��Ϊ��ԭ�ӣ���Ϊ�����ڲ���һ���þ����к�����ԭ����Ϊ16��


 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ����(����)
A.���ڱ��е����嶼�зǽ���Ԫ��
B.���ڱ��е����嶼�н���Ԫ��
C.���ڱ��еķǽ���Ԫ�ض�λ������(��ϡ������)
D.���ڱ��еķǽ���Ԫ�ض�λ�ڶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X����Һ�У�����Y�Լ��������ij�����������ͼ��ʾ����������������ǣ� �� 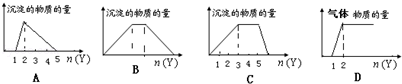
A.��HCl��AlCl3�Ļ��Һ�еμ�NaOH
B.��NaOH��Ca��OH��2�Ļ��Һ��ͨ��CO2
C.��NH4Al��SO4��2��Һ�еμ�NaOH
D.��NaOH��Na2CO3�Ļ��Һ�еμ�ϡHCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��ͨ��ʵ���о�Na2O2��ˮ�ķ�Ӧ��
���� | ���� |
��ʢ��4.0g Na2O2���ձ��м���50mL����ˮ | ���ҷ�Ӧ��������ʹ������ľ����ȼ�����壬�õ�����ɫ��Һa |
����Һa�е������η�̪ | ������Һ��� ����10���Ӻ���Һ��ɫ���Ա�dz���Ժ���Һ��Ϊ��ɫ |
��1��Na2O2�ĵ���ʽΪ___________������ˮ��Ӧ�����ӷ���ʽ��__________________��
��2����ͬѧ��Ϊ������Һ��ɫ����Һa�д��ڽ϶��H2O2��H2O2���̪�����˷�Ӧ����ʵ��֤ʵ��H2O2�Ĵ��ڣ�ȡ������Һa�������Լ�___________���ѧʽ���������������
��3����ͬѧ�������ϻ�Ϥ����KMnO4��������H2O2���ⶨ�京����ȡ20.00mL��Һ����ϡH2SO4�ữ����0.002mol/L KMnO4��Һ�ζ����������壬��Һ��ɫ�����յ�ʱ������10.00mL KMnO4��Һ��
��ʵ���У��ζ�ʱKMnO4��ҺӦװ��__________�����ʽ�ζ����С�
��������������÷�Ӧ����ת�Ƶķ������Ŀ��_______________��
2MnO4-+5H2O2+6H+ = 2Mn2++5O2��+8H2O��
����Һa�� c(H2O2)=___________ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������п����ϡ������ȡH2�����д�ʩ��ʹ��Ӧ���ʼ�������
A. ��ϡ�����м�ˮ B. ����п������ C. ��п�۴���п�� D. ���߷�Ӧ�¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ���仯����һ����(��Ͷ�)������Ⱦ��þ��طŵ�ʱ��ѹ����ƽ�ȣ����þ���Խ��Խ��Ϊ����������ɫ��صĽ��㡣����һ��þ��صķ�Ӧ��Ϊ��xMg+Mo3S4![]() MgxMo3S4����þԭ��طŵ�ʱ������˵��������ǣ�������
MgxMo3S4����þԭ��طŵ�ʱ������˵��������ǣ�������
A. Mg2+������Ǩ�� B. ������ӦΪ��Mo3S4+2xe-�TMo3S42x-
C. Mo3S4����������Ӧ D. ������ӦΪ��xMg-2xe-�TxMg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ijЩ���ӵļ��鼰����һ����ȷ����
A. ����ϡ���������ɫ���壬������ͨ�����ʯ��ˮ�У���Һ����ǣ�һ����CO![]()
B. �����Ȼ�����Һ�а�ɫ�����������ټ����ᣬ��������ʧ��һ����SO![]()
C. ��������������Һ�����ȣ�������������ʹʪ��ĺ�ɫʯ����ֽ������һ����NH![]()
D. ����̼������Һ������ɫ�������ټ������ɫ������ʧ��һ����Ba2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij100mL���Һ�У�HNO3��H2SO4�����ʵ���Ũ�ȷֱ���0.4molL��1��0.1molL��1 �� ��û��Һ�м���1.92gͭ�ۣ����ȣ�����ַ�Ӧ������Һ�������Ϊ100mL����������Һ�е�Cu2+�����ʵ���Ũ���ǣ� ��
A.0.15 molL��1
B.0.225 molL��1
C.0.35 molL��1
D.0.45 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���Aֻ����C��H��O����Ԫ�أ��������л��ϳɵ��м��塣16.8 g���л���ȼ������44.0 g CO2��14.4 g H2O������ͼ��������Է�������Ϊ84���������������A�����к���O��H����λ�ڷ��Ӷ˵�C��C�����˴Ź����������������壬�����֮��Ϊ6��1��1��
��1��A�ķ���ʽ��____________��
��2�����������У�һ������������A������Ӧ����_________________��
A��H2B��Na C������KMnO4��Һ D��Br2
��3��A�Ľṹ��ʽ��________________________��
��4���л���B��A��ͬ���칹�壬1 mol B����1 mol Br2�ӳɡ����л���������̼ԭ����ͬһ��ƽ���ϣ�û��˳���칹����B�Ľṹ��ʽ��______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com