
【题目】下列实验不能达到实验目的的是( )
序号 | 实验操作 | 实验目的 |
A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
B | 向MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
C | 测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH | 比较碳、硫的非金属性强弱 |
D | Fe、Cu分别与稀盐酸反应 | 比较铁、铜的金属性强弱 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】氢气燃烧的热化学方程式,可用下列两种方程式表示:
①2H2(g)+O2(g)=2H2O(l)+Q1kJ
②H2(g)+1/2O2(g)=H2O(g)+Q2kJ
Q1与Q2的关系为
A .Q1= Q2 B.Q2 >Q1 C.Q1>2Q2 D.Q1<2Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代化学传感器技术是研究溶液中离子反应的重要手段,电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。如图是某同学用0.1 mol·L-1KOH溶液滴定体积均为20 mL、浓度均为0.1 mol·L-1的HCl溶液和CH3COOH溶液过程中溶液电导率变化示意图。
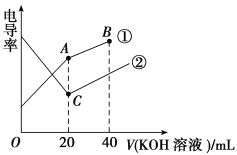
(1)曲线②代表0.1 mol·L-1KOH溶液滴定________溶液的滴定曲线。
(2)A点溶液的pH________(填“>”、“<”或“=”)C点溶液的pH。
(3)B点的溶液中离子浓度大小顺序是___________________________________。
(4)对照上述溶液电导率变化示意图,下列能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是________(填字母)。
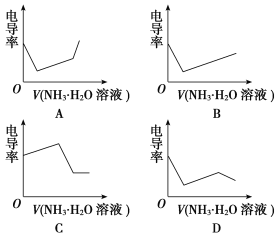
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2===CH2+H2O
CH2===CH2+H2O
CH2===CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃脱水生成乙醚用少量溴和足量的乙醇制备1,2二溴乙烷的装置如图所示:
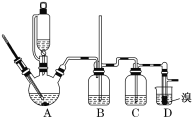
有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g·cm-3) | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是___________(填正确选项前的字母)。
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入________________(填正确选项前的字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸
c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是______________________。
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在________层(填“上”或“下”)。
(5)若产物中有少量未反应的Br2,最好用________________(填正确选项前的字母)洗涤除去。
a.水 b.氢氧化钠溶液
c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用_______________的方法除去。
(7)反应过程中应用冷水冷却装置D,其主要目的是__________________________;但又不能过度冷却(如用冰水),其原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知33As、35Br位于同一周期。下列关系正确的是( )
A. 原子半径:As>Cl>P
B. 热稳定性:HCl>AsH3>HBr
C. 还原性:As3->S2->Cl-
D. 酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茫茫黑夜中,航标灯为航海员指明了方向航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池。在这种电池中
①铝合金是阳极②铝合金是负极③海水是电解液④铝合金电极发生还原反应
A. ②④ B. ②③ C. ①② D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质结构的下列说法中正确的是( )
A. 碘升华时破坏了共价键
B. 含极性键的共价化合物一定是电解质
C. 氯化钠固体中的离子键在溶于水时被破坏
D. HF的分子间作用力大于HCl,故HF比HCl更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
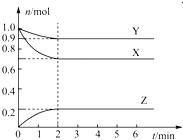
(1)该反应的化学方程式为________________________;
(2)反应开始至2min,用气体Z表示的反应速率为_____________;
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的__________倍;
②若此时将容器的体积缩小为原来的0.5倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为__________反应(填“放热”或“吸热”).
(4)若上述反应在2min后的t1~t6内反应速率与反应时间图象如下,
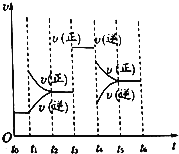
在每一时刻均改变一个影响反应速率的因素,则①t1、t3、t4时刻体系中分别改变的是什么条件?
t1:______________,t3:_______________,t4:_____________.
②下列各时间段时,Z的体积分数最高的是___________
A.t2~t3 B.t3~t4 C.t4~t5 D.t5~t6.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com