
【题目】(2017·贵州省遵义市第四中学高一上学期期中考试)由NO和CO组成的混合气体与同温同压下空气的密度相等(空气的平均相对分子质量为29),下列关系正确的是
A.混合气体中,CO与NO质量比15∶14
B.混合气体中,CO与NO分子个数比1∶2
C.混合气体中,CO占有的体积大于NO占有的体积
D.混合气体中,CO与NO密度比14∶15
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知CO和H2的混合气体称为水煤气,可由碳与水蒸气在高温下反应生成。如下图:

已知:单质E可作为半导体材料,化合物F是有毒的氧化物,C常温下为液态。据此,请填空:(用化学式回答)
(1)氧化物A是_____________
(2)化合物F是___________
(3)反应②的化学方程式是_____________________________________
(4)反应③的化学方程式是_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碰撞的说法正确的是( )
A. 活化分子之间的碰撞一定能引发化学反应,即活化分子之间的碰撞为有效碰撞
B. 发生有效碰撞的分子必为活化分子
C. 反应物分子之间的碰撞一定会引发化学键的断裂
D. 反应物分子之间只要有合适的取向的碰撞必为有效碰撞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:Pb (s)+ PbO2(s) +2H2SO4(aq)![]() 2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是
2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是
A. PbO2是电池的负极 B. 铅蓄电池属于一次电池
C. 负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) D. 电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 乙酸和甲酸甲酯互为同分异构体
B. 乙烯可以用作生产食品包装材料的原料
C. 鸡蛋消溶液中加入稀(NH4)2SO4溶液后产生沉淀,是因为蛋白质发生了盐析
D. a-氨基丙酸与a-氨基苯丙酸混合物脱水成肽,只生成2种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的废气、废液、废渣直接排放会造成污染,很多都经过吸收转化为化工产品。
I.利用电化学原理吸收工业生产中产生的SO2、NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如图(Ce为铈元素)。

请回答下列问题:
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式: 。
(2)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示:

右侧反应室中发生的主要电极反应式为 。
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为0.4 mol·L-1,要使1 m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2的体积为 L。
II.以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
![]()

(4)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(5)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。滤渣的主要成分为 (填化学式)。
(6)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL1,从该溶液中尽可能多地析出KClO3固体的方法是 。

(7)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5CaO(s)+H3PO4(l)+HF(g)=Ca5(PO4)3F(s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以肯定溶液中存在大量SO42-的理由是
A. 加入AgNO3溶液,有白色沉淀产生
B. 加入稀盐酸溶液,无明显现象,再加入BaCl2溶液,产生白色沉淀
C. 加入Ba(OH)2溶液,产生白色沉淀,再加入稀盐酸,沉淀不溶解
D. 加入BaCl2溶液,产生白色沉淀,再加入稀盐酸,沉淀不溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为周期表的一小部分,A、B、C、D、E的位置关系如下图所示。其中B元素最高价是负价绝对值的3倍,它的最高氧化物中含氧60%。下列说法正确的是( )
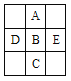
A. D、B、E三种元素的第一电离能逐渐减小
B. B元素最高价氧化物对应的水化物是强酸
C. A元素是空气中含量最多的元素
D. 气态氢化物的稳定顺序:D > B > E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A. 配制稀硫酸时,用10 mL量筒量取5.45 mL浓硫酸
B. 用稀硝酸清洗H2还原CuO后内壁附有Cu和Cu2O的试管
C. 将C与浓H2SO4反应产生的气体通入澄清石灰水检验CO2
D. 配制FeCl3溶液时,将FeCl3溶于热水中,冷却后加水稀释
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com