
【题目】下图为周期表的一小部分,A、B、C、D、E的位置关系如下图所示。其中B元素最高价是负价绝对值的3倍,它的最高氧化物中含氧60%。下列说法正确的是( )
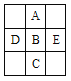
A. D、B、E三种元素的第一电离能逐渐减小
B. B元素最高价氧化物对应的水化物是强酸
C. A元素是空气中含量最多的元素
D. 气态氢化物的稳定顺序:D > B > E
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】环境问题正引起全社会的关注,用NH3催化还原NOx可以消除氮氧化物的污染,对构建生态文明有着极为重要的意义。
(1)已知N2(g)+3H2(g) ![]() 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图。
2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图。
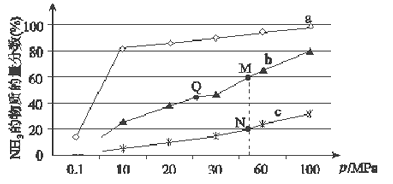
①曲线a对应的温度是_________℃。
②上图中M、N、Q三点对应的平衡常数K(M)、K(N)、K(Q)的大小关系是_________________。
如果N点时c(NH3)=0.2 mol·L-1,则N点的化学平衡常数K=______(保留2位小数)。
(2)用NH3催化还原NO时包含以下反应:
反应I:4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(l) △H1
5N2(g)+6H2O(l) △H1
反应II: 2NO(g) +O2(g) ![]() 2NO 2(g) △H2
2NO 2(g) △H2
反应III:4NH3(g)+6NO2 (g) ![]() 5N2(g)+3O2(g) + 6H2O(l) △H3
5N2(g)+3O2(g) + 6H2O(l) △H3
△H1=________(用含△H2、△H3的式子表示)。
(3)SNCR-SCR是一种新兴的烟气脱硝技术(除去烟气中的NOx)。其流程如下:

该方法中反应的热化学方程式为:
4NH3(g)+4NO (g) + O2 (g)![]() 4N2(g)+ 6H2O(g) △H=-1646 kJ·mol -1
4N2(g)+ 6H2O(g) △H=-1646 kJ·mol -1
①在一定温度下,在密闭恒压的容器中,能表示上述反应达到化学平衡状态的是_______(填字母)。
a.4v逆(N2)=v正(O2)
b.混合气体的密度保持不变
c.c(N2):c(H2O):c(NH3)=4:6:4
d.单位时间内断裂12molN-H键的同时断裂12molO-H键
②如下图所示,反应温度会直接影响SNCR技术的脱硝效率。
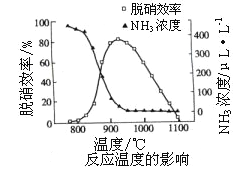
SNCR技术脱硝的最佳温度选择925℃的理由是_____________________;SNCR与SCR技术相比,SNCR技术的反应温度较高,其原因是________________;但当烟气温度高于1000℃时,SNCR脱硝效率明显降低,其原因主要是_____________________。(用平衡移动原理解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·贵州省遵义市第四中学高一上学期期中考试)由NO和CO组成的混合气体与同温同压下空气的密度相等(空气的平均相对分子质量为29),下列关系正确的是
A.混合气体中,CO与NO质量比15∶14
B.混合气体中,CO与NO分子个数比1∶2
C.混合气体中,CO占有的体积大于NO占有的体积
D.混合气体中,CO与NO密度比14∶15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期。下列说法正确的是
A. 简单离子半径R>W>Y>Z
B. 气态氢化物稳定性:HmW<HnR
C. Z2Y2电子式可表示为![]()
D. RY2和W2均有漂白性,将两者等物质的量混合溶于水,漂白性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知A、B、c、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氧化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24, ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)B、C、D的第一电离能由小到大的顺序为__________________。
(2)B的氢化物的分子空间构型是____________,其中心原子采取的杂化方式是________________。
(3)写出化合物AC2的电子式______________,一种由B、C组成的化合物与AC2互为等电子体,其化学式为_________。
(4)ECl3形成的配合物的化学式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

溶质的物质的量浓度/mol·L1 | 溶液的密度/g·cm3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为 (不写单位,用含c1、 ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为 mol·L1。
(3)将物质的量浓度分别为c2 mol·L1和![]() c2 mol·L1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm3,所得溶液的物质的量浓度
c2 mol·L1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm3,所得溶液的物质的量浓度 ![]() c2 mol·L1(设混合后溶液的体积变化忽略不计)。
c2 mol·L1(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程溶液pH随NaOH溶液的体积的变化曲线如图所示(忽略中和热效应)。下列说法不正确的是

A. 常温下,HA的电离常数K(HA)约为10-5
B. v1<20
C. 溶液中水的电离程度:a点>b点
D. 滴定过程为了确定滴定终点,最合适的指示剂是酚酞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展密切相关,下列行为中不符合“促进低碳经济”宗旨的是
A. 尽量使用含![]() 的产品,减少使用含
的产品,减少使用含![]() 或
或 ![]() 的产品
的产品
B. 发展水电、开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖
C. 推广煤的干馏、气化、液化技术,提供清洁、高效燃料和基础化工原料
D. 推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com