
【题目】已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

溶质的物质的量浓度/mol·L1 | 溶液的密度/g·cm3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为 (不写单位,用含c1、 ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为 mol·L1。
(3)将物质的量浓度分别为c2 mol·L1和![]() c2 mol·L1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm3,所得溶液的物质的量浓度
c2 mol·L1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm3,所得溶液的物质的量浓度 ![]() c2 mol·L1(设混合后溶液的体积变化忽略不计)。
c2 mol·L1(设混合后溶液的体积变化忽略不计)。
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和SO42-的离子个数比为
A. 1:2 B. 1:4 C. 3:4 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的废气、废液、废渣直接排放会造成污染,很多都经过吸收转化为化工产品。
I.利用电化学原理吸收工业生产中产生的SO2、NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如图(Ce为铈元素)。

请回答下列问题:
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式: 。
(2)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示:

右侧反应室中发生的主要电极反应式为 。
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为0.4 mol·L-1,要使1 m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2的体积为 L。
II.以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
![]()

(4)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(5)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。滤渣的主要成分为 (填化学式)。
(6)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL1,从该溶液中尽可能多地析出KClO3固体的方法是 。

(7)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5CaO(s)+H3PO4(l)+HF(g)=Ca5(PO4)3F(s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用等体积的0.1 mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的![]() 完全沉淀,则三种硫酸盐的物质的量浓度之比为
完全沉淀,则三种硫酸盐的物质的量浓度之比为
A.3∶2∶3 B.3∶1∶2
C.2∶6∶3 D.1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为周期表的一小部分,A、B、C、D、E的位置关系如下图所示。其中B元素最高价是负价绝对值的3倍,它的最高氧化物中含氧60%。下列说法正确的是( )
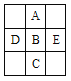
A. D、B、E三种元素的第一电离能逐渐减小
B. B元素最高价氧化物对应的水化物是强酸
C. A元素是空气中含量最多的元素
D. 气态氢化物的稳定顺序:D > B > E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将符合反应类型的选项字母填在横线上:
A.Fe3O4+4CO![]() 3Fe+4CO2
3Fe+4CO2
B.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C.Zn+H2SO4![]() ZnSO4+H2↑
ZnSO4+H2↑
D.CaCO3+2HCl![]() CaCl2+H2O+CO2↑
CaCl2+H2O+CO2↑
E.C2H5OH(酒精)+3O2![]() 2CO2+3H2O
2CO2+3H2O
F.3Fe+2O2![]() Fe3O4
Fe3O4
G.CuO+H2![]() Cu+H2O
Cu+H2O
H.HCl+NaOH![]() H2O+NaCl
H2O+NaCl
(1)属于化合反应的有________;
(2)属于分解反应的有________;
(3)属于复分解反应的有________;
(4)属于置换反应的有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是

A. 原子半径:W> Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 4种元素的单质中,Z单质的熔、沸点最低
D. W单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验或实验操作和现象,所得结论正确的是
实验或实验操作 | 现象 | 实验结论 | |
A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
C |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,H2S的饱和溶液1L,其浓度为0.1mol/L,若要使溶液的pH增大的同时c(S2-)增大,可采取的措施是
A. 加入适量的水 B. 加入适量的NaOH固体
C. 通入适量的SO2 D. 加入适量的CuSO4固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com