
【题目】某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和SO42-的离子个数比为
A. 1:2 B. 1:4 C. 3:4 D. 3:2
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】用自来水养金鱼时,将水注入鱼缸以前需把水放在阳光下暴晒一段时间,目的是( )
A. 起到杀菌作用 B. 使水中次氯酸分解
C. 提高水的温度 D. 增加水中氧气的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)![]() Ni(CO) 4(g),已知该反应平衡常数与温度的关系如表:
Ni(CO) 4(g),已知该反应平衡常数与温度的关系如表:

下列说法不正确的是
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g)![]() Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
C.在80℃时,测得某时刻,Ni(CO)4(g)、CO浓度均为0.5mol/L,则此时v(正)>v(逆)
D.80℃达到平衡时,测得n(CO)=0.15mol,则Ni(CO)4的平衡浓度为0.125mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关除杂方法正确的是
A. 除去Fe3+中Al3+:加入过量氨水充分反应后,过滤
B. 除去FeCl3中少量CuCl2:用足量的铁粉,过滤
C. 除去石英中的碳酸钙:用足量稀盐酸溶解后,过滤
D. 除去铝粉中的镁粉:加入足量的氢氧化钠溶液后,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题正引起全社会的关注,用NH3催化还原NOx可以消除氮氧化物的污染,对构建生态文明有着极为重要的意义。
(1)已知N2(g)+3H2(g) ![]() 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图。
2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图。
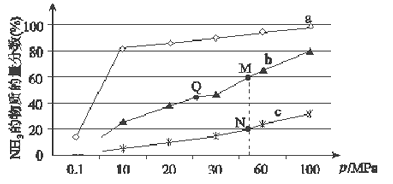
①曲线a对应的温度是_________℃。
②上图中M、N、Q三点对应的平衡常数K(M)、K(N)、K(Q)的大小关系是_________________。
如果N点时c(NH3)=0.2 mol·L-1,则N点的化学平衡常数K=______(保留2位小数)。
(2)用NH3催化还原NO时包含以下反应:
反应I:4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(l) △H1
5N2(g)+6H2O(l) △H1
反应II: 2NO(g) +O2(g) ![]() 2NO 2(g) △H2
2NO 2(g) △H2
反应III:4NH3(g)+6NO2 (g) ![]() 5N2(g)+3O2(g) + 6H2O(l) △H3
5N2(g)+3O2(g) + 6H2O(l) △H3
△H1=________(用含△H2、△H3的式子表示)。
(3)SNCR-SCR是一种新兴的烟气脱硝技术(除去烟气中的NOx)。其流程如下:

该方法中反应的热化学方程式为:
4NH3(g)+4NO (g) + O2 (g)![]() 4N2(g)+ 6H2O(g) △H=-1646 kJ·mol -1
4N2(g)+ 6H2O(g) △H=-1646 kJ·mol -1
①在一定温度下,在密闭恒压的容器中,能表示上述反应达到化学平衡状态的是_______(填字母)。
a.4v逆(N2)=v正(O2)
b.混合气体的密度保持不变
c.c(N2):c(H2O):c(NH3)=4:6:4
d.单位时间内断裂12molN-H键的同时断裂12molO-H键
②如下图所示,反应温度会直接影响SNCR技术的脱硝效率。
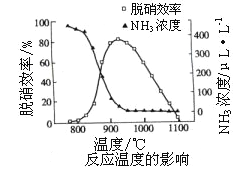
SNCR技术脱硝的最佳温度选择925℃的理由是_____________________;SNCR与SCR技术相比,SNCR技术的反应温度较高,其原因是________________;但当烟气温度高于1000℃时,SNCR脱硝效率明显降低,其原因主要是_____________________。(用平衡移动原理解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO4和NaHCO3是常见的酸式盐,是水溶液中离子平衡部分重要的研究对象。
请运用相关原理,回答下列有关小题。
(1)NaHSO4在水中的电离方程式________________。室温下,pH=5的NaHSO4放热溶液中水的电离程度___________(填“>”、“<”或“=”)pH=9的氨水中水的电离程度。
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为___________(用离子方程式表示)。
(3)室温下,若一定量的NaHSO4溶液与氨水混合后,溶液PH=7,则c(Na+)+c(NH4+)_______2c(SO42-)(填“>”、“<”或“=”)
(4)室温下,用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH_________7 (填“>”、“<”或“=”)。
(5)室温下,0.1mol/L的NaHCO3溶液的pH为8.4,同浓度的Na[Al(OH)4]溶液的pH为12.4。同浓度的Na2CO3溶液的pH为11.4。
①将NaHCO3和Na[Al(OH)4]两种溶液等体积混合,可能发生的现象是________,其主要原因是(用离子方程式表示)_______。
②上述溶液中,由NaHCO3水解产生的c(OH-)约是由Na2CO3水解产生的c(OH-)的______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

溶质的物质的量浓度/mol·L1 | 溶液的密度/g·cm3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为 (不写单位,用含c1、 ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为 mol·L1。
(3)将物质的量浓度分别为c2 mol·L1和![]() c2 mol·L1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm3,所得溶液的物质的量浓度
c2 mol·L1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm3,所得溶液的物质的量浓度 ![]() c2 mol·L1(设混合后溶液的体积变化忽略不计)。
c2 mol·L1(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com