
下列变化需克服相同类型作用力的是
A.碘和干冰的升华 B.硅和C60的熔化
C.氯化氢和氯化钾的溶解 D.溴和汞的气化
科目:高中化学 来源:2014-2015学年四川邛崃市高三上学期第一次月考化学试卷(解析版) 题型:填空题
中航工业成都飞机工业(集团)有限责任公司为中国航空事业做出了巨大贡献,先后研制了歼5、歼教5、歼7、歼教7、歼10、枭龙等歼击机和教练机。银铜合金广泛应用于航空工业。从切割废料中回收银并制备铜的化工产品工艺如下:
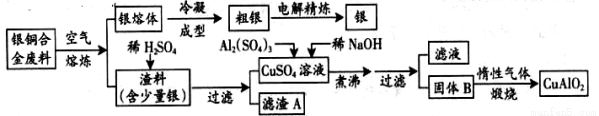
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极电极反应式为 ;
滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,将红棕色气体溶于水的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)配平煅烧过程中一个反应的化学方程式:
CuO + Al2O3 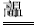 CuAlO2 + ↑
CuAlO2 + ↑
(4)CuSO4溶液也可用于制备胆矾,其基本操作是 、 、过滤、洗涤和干燥。
(5)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为CuAlO2,至少需要1.0mol/L的Al2(SO4)3溶液 L。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省邛崃市高二上学期半期考试化学试卷(解析版) 题型:选择题
SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx分解成无害的N2和H2O的干法脱硝技术,反应原理为:①6NO+4NH3===5N2+6H2O;②6NO2+8NH3===7N2+12H2O;③NO+NO2+2NH3===2N2+3H2O。下列说法正确的是
A.汽车尾气中含有NOx,NOx是引起温室效应的主要气体之一
B.N2中π键与σ键之比为1:2
C.反应③中每生成标况下的22.4 L N2转移电子数1.5NA
D.NH3的沸点比PH3的沸点高
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省邛崃市高二上学期半期考试化学试卷(解析版) 题型:选择题
下列关于杂化轨道的叙述中,不正确的是
A.分子中中心原子通过sp2杂化轨道成键时,该分子不一定为平面三角形结构
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子
C.N2分子中N原子没有杂化,分子中有1个σ键、2个π键
D.H2SO4分子中三种原子均以杂化轨道成键
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省邛崃市高二上学期半期考试化学试卷(解析版) 题型:选择题
以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
A.∶He B.1s2
C.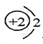 D.
D.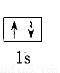
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高一10月月考化学试卷(解析版) 题型:填空题
(10分)(1)1.7g NH3共有 mol 原子;0.1mol CH4 在标准状况下含有的电子数为 ,体积约为 。在同温同压下,同体积的NH3和CH4的质量比为_____________;在同温同压下,同质量的NH3和CH4的体积比为______________。
(2)已知1.2g RSO4中含0.01molR2+,则RSO4的摩尔质量是 ;R的相对原子质量是 。
(3)如图所示是医院为病人输液时用的一瓶质量分数为5%的葡萄糖(其分子式为C6H12O6)注射液标签,则该溶液中含水的质量为 ;该溶液的密度约为 ;该溶液的溶质的物质的量浓度为 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都外国语学校高二上学期期中化学试卷(解析版) 题型:填空题
(每空2分,共16分).已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为产生温室效应的主要气体。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24, ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物分子的立体构型是 其中心原子采取 _杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4) E的核外电子排布式是__ ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反
应的化学方程式是
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川成都树德协进中学高二10月阶段性考试化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列说法不正确的是
A.在标准状况下,2.24L CCl4中含有C—Cl键的数目为0. 4NA
B.0.2molPCl5分子中, 键数目为NA
键数目为NA
C.28g聚乙烯分子中含有的碳原子数为2NA
D.0.1mol椅式环已烷所含C—C数目为0.6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com