
(每空2分,共16分).已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为产生温室效应的主要气体。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24, ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物分子的立体构型是 其中心原子采取 _杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4) E的核外电子排布式是__ ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反
应的化学方程式是
(1)C<O<N (2)三角锥形 sp3 (3)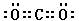 N2O
N2O
(4)1s22s22p63s23p63d54s1(或[Ar] 3d54s1) [Cr(NH3)4(H2O)2]Cl3
(5)4Mg+10HNO3(稀)=4Mg(NO3)2+NH4NO3+3H2O
【解析】
试题解析:A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,C形成-2价阴离子,且D位于C的下一周期,B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,分子中应存在氢键,C形成-2价阴离子,则C为氧元素,D为镁元素,核电荷数B<C,则B为氮元素;其中A、B、C是同一周期的非金属元素,AC2为非极性分子,则A为碳元素;E的原子序数为24,则E为Cr元素;CrCl3能与NH3、H2O形成六配位的配合物,且两种配体的物质的量之比为2:1,则配体中有4个NH3、2个H2O,三个氯离子位于外界,该配合物为[Cr(NH3)4(H2O)2]Cl3.故A为碳元素;B为氮元素;C为氧元素,D为镁元素,E为Cr元素。(1)A为碳元素、B为氮元素、C为氧元素,同周期自左而右第一电离能增大,氮元素原子2p能级有3个电子,处于半满稳定状态,电子能量低,氮元素第一电离能高于相邻的元素的,所以第一电离能由小到大的顺序为C<O<N。(2)B为氮元素,其氢化物为NH3,分子中含有3个N-H键,N原子有1对孤对电子对,杂化轨道数为4,N原子采取sp3杂化,空间构型为三角锥型。(3)化合物AC2是CO2,分子中碳原子与氧原子之间形成2对共用电子对,电子式为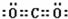 ;一种由N元素、O元素化合物与CO2互为等电子体,其化学式为N2O。(4)E为Cr元素,原子序数为24,原子核外有24个电子,核外电子排布式是 1s22s22p63s23p63d54s1;CrCl3能与NH3、H2O形成六配位的配合物,且两种配体的物质的量之比为2:1,则配体中有4个NH3、2个H2O,三个氯离子位于外界,该配合物为[Cr(NH3)4(H2O)2]Cl3。(5)B的最高价氧化物对应的水化物为HNO3,D的单质为Mg,HNO3稀溶液与Mg反应时,N元素被还原到最低价,则生成NH4NO3,Mg被氧化为Mg(NO3)2,令NH4NO3,Mg(NO3)2的化学计量数分别为x、y,则根据电子转移守恒有[5-(-3)]×x=2y,所以x:y=4:1,该反应的化学方程式是4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O。
;一种由N元素、O元素化合物与CO2互为等电子体,其化学式为N2O。(4)E为Cr元素,原子序数为24,原子核外有24个电子,核外电子排布式是 1s22s22p63s23p63d54s1;CrCl3能与NH3、H2O形成六配位的配合物,且两种配体的物质的量之比为2:1,则配体中有4个NH3、2个H2O,三个氯离子位于外界,该配合物为[Cr(NH3)4(H2O)2]Cl3。(5)B的最高价氧化物对应的水化物为HNO3,D的单质为Mg,HNO3稀溶液与Mg反应时,N元素被还原到最低价,则生成NH4NO3,Mg被氧化为Mg(NO3)2,令NH4NO3,Mg(NO3)2的化学计量数分别为x、y,则根据电子转移守恒有[5-(-3)]×x=2y,所以x:y=4:1,该反应的化学方程式是4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O。
考点:原子结构与元素周期律的关系;配合物的成键情况;原子轨道杂化方式及杂化类型判断


科目:高中化学 来源:2014-2015学年四川邛崃市高二上学期第一次月考化学试卷(解析版) 题型:选择题
核磁共振(NMR)技术已广泛应用于复杂分子结构测定和医学诊断等高科技领域。已知只有质子数和中子数均为奇数的原子核有NMR现象。试判断下列原子均可产生NMR现象的是
A.18O31P119Sn
B.27Al19F12C
C.80Br2H14N
D.元素周期表中第一周期所有元素的原子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省邛崃市高二上学期半期考试化学试卷(解析版) 题型:选择题
下列变化需克服相同类型作用力的是
A.碘和干冰的升华 B.硅和C60的熔化
C.氯化氢和氯化钾的溶解 D.溴和汞的气化
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高一10月月考化学试卷(解析版) 题型:选择题
由FeO、Fe2O3、Fe3O4组成的混合物,测得其中铁元素和氧元素的质量比为21/8,则这种混合物中FeO 、Fe2O3、Fe3O4的物质的量之比可能为
A.1:2:1 B.2:1:1 C.1:1:1 D.1:2:3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃即开始升华。在500K和1.01×105Pa时,它的蒸气密度(换算为标准状况)为11.92g/L。有关氯化铝的叙述中错误的是
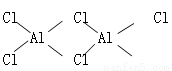
A.氯化铝是共价化合物
B.氯化铝的化学式应为Al2Cl6
C.氯化铝的结构式如图:分子结构中有配位键
D.在一定条件下,将AlCl3晶体加热至融化,熔融态的AlCl3可以导电
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
在如图所示的装置中,干燥烧瓶内盛有某种气体,烧杯和胶头管内盛放某种液体。挤压滴管的胶头,
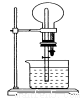
下列与实验事实不相符的是
A.CO2(NaHCO3溶液)/无色喷泉
B.NH3(H2O含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉
D.HCl(AgNO3溶液)/白色喷泉
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川成都树德协进中学高二10月阶段性考试化学试卷(解析版) 题型:填空题
(12分)过渡金属在生产生活中的应用十分广泛。
Ⅰ.Cr元素形成的氯化铬酰(CrO2Cl2)有重要用途,在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
Ⅱ.Cu可形成多种配合物,根据下列信息回答问题:
(1)向盛有硫酸铜水溶液的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色的透明溶液,请写出先后发生的离子方程式
;
。
深蓝色溶液中配离子的立体构型为 。
(2)再向深蓝色透明溶液加入乙醇,析出深蓝色的晶体。深蓝色晶体的化学式为 。
(3)根据以上实验过程,判断NH3和H2O与Cu2+的配位能力:NH3 H2O(填“>”、“=”或“<”);
Ⅲ.Ni(CO)6为正八面体结构,其中的镍原子位于正八面体的中心,配位体CO分子则在正八面体的六个顶点上。
(4)若把其中两个CO配位体换成 NH3 得到新的配合物,则以下物质中互为同分异构体的是 。(填字母编号,任填一组。图中黑点为NH3,圆圈为CO,Ni略去)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春市新高三起点调研考试化学试卷(解析版) 题型:选择题
用下列装置进行实验,设计正确且能达到实验目的的是
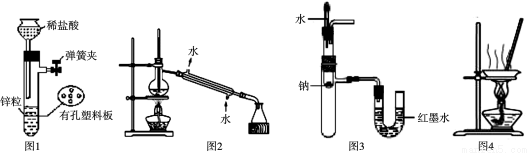
A.用图1所示装置制取少量H2
B.用图2所示装置分离Na2CO3溶液和CH3COOC2H5的混合物
C.用图3所示装置验证Na和水反应为放热反应
D.用图4所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com