
(12分)过渡金属在生产生活中的应用十分广泛。
Ⅰ.Cr元素形成的氯化铬酰(CrO2Cl2)有重要用途,在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
Ⅱ.Cu可形成多种配合物,根据下列信息回答问题:
(1)向盛有硫酸铜水溶液的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色的透明溶液,请写出先后发生的离子方程式
;
。
深蓝色溶液中配离子的立体构型为 。
(2)再向深蓝色透明溶液加入乙醇,析出深蓝色的晶体。深蓝色晶体的化学式为 。
(3)根据以上实验过程,判断NH3和H2O与Cu2+的配位能力:NH3 H2O(填“>”、“=”或“<”);
Ⅲ.Ni(CO)6为正八面体结构,其中的镍原子位于正八面体的中心,配位体CO分子则在正八面体的六个顶点上。
(4)若把其中两个CO配位体换成 NH3 得到新的配合物,则以下物质中互为同分异构体的是 。(填字母编号,任填一组。图中黑点为NH3,圆圈为CO,Ni略去)
(12分)
(1)Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+(2分)
Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O (2分) 平面四边形(2分)
(2)[Cu(NH3)4]SO4.H2O(2分)
(3)> (2分)
(4)AE与BCD的任意组合,出现相同的答案则不给分(2分)。
【解析】
试题分析:(1)向盛有硫酸铜水溶液的试管里逐滴加入氨水,首先出现蓝色沉淀,该蓝色沉淀是氢氧化铜,方式的离子方程式为Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+;后加入氨水,沉淀溶解,生成四氨合铜络离子,离子方程式为Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O;深蓝色溶液中配离子是[Cu(NH3)4]2+,立体构型为平面四边形;
(2)再向深蓝色透明溶液加入乙醇,析出深蓝色的晶体,该深蓝色晶体是[Cu(NH3)4]SO4.H2O;
(3)根据以上实验过程,说明氨气比水更易与Cu2+结合而形成配离子,所以配位能力NH3> H2O;
(4)由结构图可知,A与E是同种结构,B与C是同种结构,D是一种结构,所以A(或E)与B、C、D中的一种互为同分异构体,或B与E、B与D、C与D、C与E都是同分异构体。
考点:考查配合物理论的应用,离子方程式的书写,同分异构体的判断


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源:2014-2015学年四川省邛崃市高二上学期半期考试化学试卷(解析版) 题型:选择题
SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx分解成无害的N2和H2O的干法脱硝技术,反应原理为:①6NO+4NH3===5N2+6H2O;②6NO2+8NH3===7N2+12H2O;③NO+NO2+2NH3===2N2+3H2O。下列说法正确的是
A.汽车尾气中含有NOx,NOx是引起温室效应的主要气体之一
B.N2中π键与σ键之比为1:2
C.反应③中每生成标况下的22.4 L N2转移电子数1.5NA
D.NH3的沸点比PH3的沸点高
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都外国语学校高二上学期期中化学试卷(解析版) 题型:填空题
(每空2分,共16分).已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为产生温室效应的主要气体。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24, ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物分子的立体构型是 其中心原子采取 _杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4) E的核外电子排布式是__ ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反
应的化学方程式是
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.任何晶体中,若含有阳离子也一定含有阴离子
B.金属镁的熔点、硬度高于铝
C.在铜的晶胞结构中,每个晶胞中平均有4个铜原子,铜原子的配位数为6
D.金属具有良好的导电性,是因为在金属晶体中共享了金属原子的价电子,形成了“电子气”,在外电场的作用下自由电子定向移动便形成了电流,所以金属易导电。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
下列有关晶体的说法中一定正确的是
①原子晶体中只存在非极性共价键
②稀有气体形成的晶体属于原子晶体
③干冰晶体升华时,分子内共价键会发生断裂
④金属元素和非金属元素形成的化合物一定是离子化合物
⑤分子晶体的堆积均为分子密堆积
⑥离子晶体和金属晶体中均存在阳离子,但金属晶体中却不存在离子键
⑦金属晶体和离子晶体都能导电
⑧依据构成粒子的堆积方式可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体
A.①③⑦ B.只有⑥ C.②④⑤⑦ D.⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川成都树德协进中学高二10月阶段性考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.除稀有气体外的非金属元素都能生成不同价态的含氧酸
B.若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数一定为m+11
C.在BrCH=CHBr分子中,C—Br键采用的成键轨道是sp—p
D.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,可能是含有共价键的离子化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川成都树德协进中学高二10月阶段性考试化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列说法不正确的是
A.在标准状况下,2.24L CCl4中含有C—Cl键的数目为0. 4NA
B.0.2molPCl5分子中, 键数目为NA
键数目为NA
C.28g聚乙烯分子中含有的碳原子数为2NA
D.0.1mol椅式环已烷所含C—C数目为0.6NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春市新高三起点调研考试化学试卷(解析版) 题型:填空题
(13分)
(1)25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010。请回答下列问题:
①HA是 (填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是 (填字母)。
A.c(H+)/c(HA) B.c(HA)/(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
(2)已知:①CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
②CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(3)下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图:
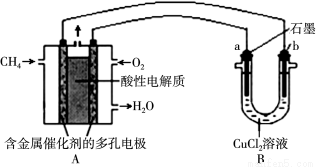
请回答:
① 甲烷燃料电池的负极反应式为 。
② 当线路中有0.6mol电子通过时,B中阳极产物的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春外国语学校高一上学期期中化学试卷(解析版) 题型:填空题
实验室制欲用固体NaOH来配0.5mol/L的NaOH溶液500mL,有以下仪器:①烧杯 ②100 mL量筒 ③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)⑦药匙
(1)配制时,必须使用的仪器有____________(填代号),还缺少的仪器是
(2)实验两次用到玻璃棒,其作用分别是:_________ _____、______________。
(3)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为_________ 。
(4)在配制过程中,若其它操作均正确,下列操作会引起结果偏高的是
A、没有洗涤烧杯和玻璃棒
B、未等NaOH溶液冷却至室温就转移到容量瓶中
C、容量瓶不干燥,含有少量蒸馏水
D、定容时俯视标线
E、称量时间过长
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com