
【题目】已知:A 是石油裂解气的主要产物之一,其产量常用于衡量一个国家石油化工发展水平的标志。下列是有机物 A~G 之间的转化关系:
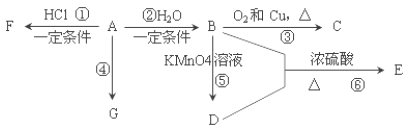
请回答下列问题:
(1)A 的官能团的名称是___________; C 的结构简式是________;
(2)E 是一种具有香味的液体, 由 B+D→E 的反应方程式为___________, 该反应类型是______________;
(3)G 是一种高分子化合物,其结构简式是______________;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质 F(沸点 12.27°C)进行应急处理.写出由A 制 F 的化学反应方程式______________。
(5)E 的同分异构体能与 NaHCO3溶液反应,写出该同分异构体的结构简式_______。
【答案】 碳碳双键 CH3CHO CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O 酯化反应(或取代反应)
CH3COOCH2CH3+H2O 酯化反应(或取代反应) ![]() CH2=CH2+HCl
CH2=CH2+HCl![]() CH3CH2Cl CH3CH2CH2COOH;(CH3)2CHCOOH
CH3CH2Cl CH3CH2CH2COOH;(CH3)2CHCOOH
【解析】A是石油裂解气的主要成份,它的产量通常用来衡量一个国家石油化工水平,A是乙烯,乙烯和水发生加成反应生成B,则B是乙醇,乙醇和氧气在铜作催化剂作用下催化反应生成C,则C是乙醛,B乙醇在高锰酸钾作用下生成D,D是乙酸,乙醇和乙酸载浓硫酸作用下反应生成乙酸乙酯E.G是一种高分子化合物,由A乙烯加聚而成为聚乙烯![]() ,F为A乙烯和氯化氢加成而成为氯乙烷,(1)A为乙烯含有谈谈双键,C为乙醛;(2)E是一种具有香味的液体,为乙酸乙酯,B+D为乙酸和乙醇反应生成乙酸乙酯和水,属于酯化反应;(3)高分子化合物中重复出现的结构单元叫链节,G为聚乙烯,其链节为-CH2-CH2-;(4)乙烯和氯化氢加成生成氯乙烷,根据氯乙烷的性质分析其用途;(5) E 的同分异构体能与 NaHCO3溶液反应则含有羧基。
,F为A乙烯和氯化氢加成而成为氯乙烷,(1)A为乙烯含有谈谈双键,C为乙醛;(2)E是一种具有香味的液体,为乙酸乙酯,B+D为乙酸和乙醇反应生成乙酸乙酯和水,属于酯化反应;(3)高分子化合物中重复出现的结构单元叫链节,G为聚乙烯,其链节为-CH2-CH2-;(4)乙烯和氯化氢加成生成氯乙烷,根据氯乙烷的性质分析其用途;(5) E 的同分异构体能与 NaHCO3溶液反应则含有羧基。
A是石油裂解气的主要成份,它的产量通常用来衡量一个国家石油化工水平,A是乙烯,乙烯和水发生加成反应CH2=CH2+H2O![]() CH3CH2OH生成B,则B是乙醇,乙醇和氧气在铜作催化剂作用下催化反应生成C,2CH3CH2OH+O2
CH3CH2OH生成B,则B是乙醇,乙醇和氧气在铜作催化剂作用下催化反应生成C,2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O,则C是乙醛,B乙醇在高锰酸钾作用下生成D,2C2H5OH+2KMnO4+5H2SO4=K2SO4+2MnSO4+2CH3COOH+7H2O,D是乙酸,乙醇和乙酸载浓硫酸作用下反应,CH3CH2OH+CH3COOH
2CH3CHO+2H2O,则C是乙醛,B乙醇在高锰酸钾作用下生成D,2C2H5OH+2KMnO4+5H2SO4=K2SO4+2MnSO4+2CH3COOH+7H2O,D是乙酸,乙醇和乙酸载浓硫酸作用下反应,CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O,生成乙酸乙酯E。G是一种高分子化合物,由A乙烯加聚而成为聚乙烯,F为A乙烯和氯化氢加成而成CH2=CH2+HC1→CH3CH2C1,为氯乙烷。(1)A为乙烯,结构简式为:CH2=CH2,含有碳碳双键,A是乙烯,B是乙醇,乙醇和氧气在铜作催化剂作用下催化反应生成C,则C是乙醛,C的结构简式为CH3CHO;(2)E是一种具有香味的液体,为乙酸乙酯,B是乙醇,B乙醇在高锰酸钾作用下生成D,2C2H5OH+2KMnO4+5H2SO4=K2SO4+2MnSO4+2CH3COOH+7H2O,D是乙酸,乙醇和乙酸载浓硫酸作用下发生酯化反应:CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O,生成乙酸乙酯E。G是一种高分子化合物,由A乙烯加聚而成为聚乙烯,F为A乙烯和氯化氢加成而成CH2=CH2+HC1→CH3CH2C1,为氯乙烷。(1)A为乙烯,结构简式为:CH2=CH2,含有碳碳双键,A是乙烯,B是乙醇,乙醇和氧气在铜作催化剂作用下催化反应生成C,则C是乙醛,C的结构简式为CH3CHO;(2)E是一种具有香味的液体,为乙酸乙酯,B是乙醇,B乙醇在高锰酸钾作用下生成D,2C2H5OH+2KMnO4+5H2SO4=K2SO4+2MnSO4+2CH3COOH+7H2O,D是乙酸,乙醇和乙酸载浓硫酸作用下发生酯化反应:CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O;(3)高分子化合物中重复出现的结构单元叫链节,G是一种高分子化合物,由A乙烯加聚而成为聚乙烯,其链节为-CH2-CH2-;(4)F为A乙烯和氯化氢反应的产物,乙烯和氯化氢在一定条件下发生加成反应生成氯乙烷,方程式为:CH2=CH2+HCl→CH3CH2Cl,氯乙烷沸点低、易挥发,使受伤部位皮肤表面温度骤然下降,能减轻伤员的痛感;(5) E (CH3COOCH2CH3)的同分异构体能与 NaHCO3溶液反应则含有羧基,该同分异构体的结构简式为CH3CH2CH2COOH或(CH3)2CHCOOH。
CH3COOCH2CH3+H2O;(3)高分子化合物中重复出现的结构单元叫链节,G是一种高分子化合物,由A乙烯加聚而成为聚乙烯,其链节为-CH2-CH2-;(4)F为A乙烯和氯化氢反应的产物,乙烯和氯化氢在一定条件下发生加成反应生成氯乙烷,方程式为:CH2=CH2+HCl→CH3CH2Cl,氯乙烷沸点低、易挥发,使受伤部位皮肤表面温度骤然下降,能减轻伤员的痛感;(5) E (CH3COOCH2CH3)的同分异构体能与 NaHCO3溶液反应则含有羧基,该同分异构体的结构简式为CH3CH2CH2COOH或(CH3)2CHCOOH。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20 mL 0.01 mol/L KCl溶液 ②30 mL 0.02 mol/L CaCl2溶液
③40 mL 0.03 mol/L HCl溶液 ④10 mL 蒸馏水⑤50 mL 0.05 mol/L AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关电化学知识的描述正确的是
A. 由于CaO+H2O![]() Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池
Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池
B. 当马口铁(镀锡铁)的镀层破损后,马口铁腐蚀会加快
C. 原电池的电极附近溶液pH的变化可以用电池总反应式来判断
D. 铅蓄电池放电时的正极反应式为PbO2 +4H+ +2e-![]() Pb2+ +2H2O
Pb2+ +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷是液化石油气主要成分之一,是一种优良的燃料。试回答下列问题:
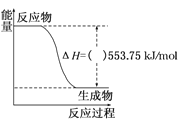
(1)如图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,(图中的括号内填入“+”或“﹣”)_____。写出表示丙烷燃烧热的热化学方程式:_________________________
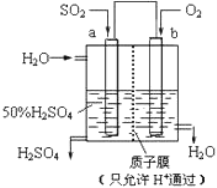
(2)科研人员设想用如图所示装置生产硫酸。
①上述生产硫酸的总反应方程式为_____________,b 是___________ 极(填“正”或“负”),b 电极反应式为______________________________,a 电极发生______________ (填“氧化反应”或“还原反应”)。②生产过程中H+向_____(填 a 或 b)电极区域运动。
(3)将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,可构成甲烷燃料电池,已知通入甲烷的一极为负极,其电极反应式为:_______________________。电池在放电过程中,溶液的pH值将______________ 。(填“下降”“上升”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱的原料,也是一种常用的制冷剂。
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L 的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间 /min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25 min 时,以N2 表示的平均反应速率=__________。
(2)工业合成氨的反应方程式为: N2(g)+3H2(g)![]() 2NH3(g) ΔH 下图Ⅰ是合成氨反应的能量与反应过程相关图(未使用催化剂);图Ⅱ是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) ΔH 下图Ⅰ是合成氨反应的能量与反应过程相关图(未使用催化剂);图Ⅱ是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
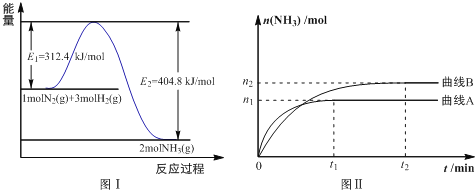
下列说法正确的是________________。
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的浓度越低越好
D.图Ⅱ是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
E.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为![]() mol·L-1·min-1
mol·L-1·min-1
(3)一定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器的压强为起始时的7/9倍,在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
(二) 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
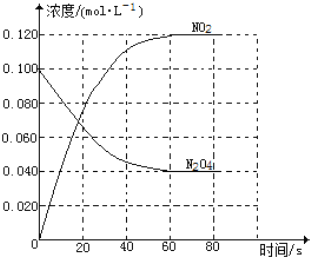
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________mol·L-1·s-1
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。T_______100℃(填“大于”“小于”),判断理由是________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动,判断理由是__________________。
(4)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应2CH3OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=____________ kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)![]() 2C1NO(g),
2C1NO(g),
(1)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):
化学键 | N≡O | Cl-Cl | Cl-N | N=O |
键能(kJ/mol) | 630 | 243 | a | 607 |
则2NO(g)+C12(g)![]() 2C1NO(g)反应的△H和a的关系为△H=____kJ/mol。
2C1NO(g)反应的△H和a的关系为△H=____kJ/mol。
(2)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
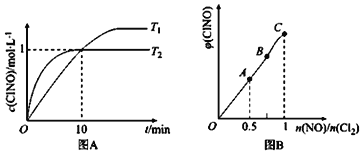
① 由图A可判断T1 ____T2,该反应的△H____0 (填“>”“<”或“=”)。
② 反应开始到10min时NO的平均反应速率v(NO)=______mol/(L·min)。
(3)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨所需的H2可由煤和水蒸气反应而制得,其中一步的反应为:CO(g)+H2O(g)CO2(g)+H2(g) ΔH< 0,下列措施中,能提高CO转化率的是( )
A.增大压强B.升高温度C.增大水蒸气浓度D.增大CO浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应3A(g)+B(g)![]() 2C(g)+2D(g) ΔH<0,图中,a、b曲线分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措施是
2C(g)+2D(g) ΔH<0,图中,a、b曲线分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措施是

①增大A的浓度 ②升高温度 ③增大D浓度 ④加入催化剂 ⑤恒温下,缩小反应容器体积 ⑥加入稀有气体,保持容器内压强不变
A. ①②③ B. ④⑤ C. ③④⑤ D. ④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com