
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
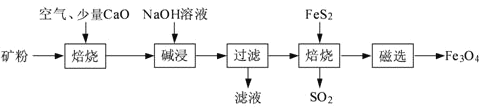
(1)粉碎高硫铝土矿石的目的是___。
(2)第一次焙烧时发生氧化还原反应:___。
(3)碱浸时发生反应的化学方程式为___。
(4)过滤后向滤液中通入过量的CO2气体,反应的离子方程式为___;___。
(5)“过滤”得到的滤渣中含有大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2):n(Fe2O3)=___。
【答案】增大接触面积,加快反应速率 4FeS2+11O2![]() 2Fe2O3+8SO2 Al2O3+2NaOH=2NaAlO2+H2O OH-+CO2=HCO3- AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ 1:16
2Fe2O3+8SO2 Al2O3+2NaOH=2NaAlO2+H2O OH-+CO2=HCO3- AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ 1:16
【解析】
高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)粉碎后通入空气、加入氧化钙焙烧,其中氧化钙和二氧化硫反应生成亚硫酸钙,和二氧化硅反应生成硅酸钙,得到产物加入氢氧化钠溶液碱浸其中氧化铝溶解生成偏铝酸钠溶液,经操作Ⅰ得到的固体中含大量的Fe2O3.Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2
(1)矿石粉碎可以增大固体和气体接触面积,加快反应速率。
(2)焙烧时发生氧化还原反应,第一次焙烧时发生氧化还原反应:4FeS2+11O2![]() 2Fe2O3+8SO2。
2Fe2O3+8SO2。
(3)过滤前使用NaOH溶液进行碱浸,Al2O3转化为NaAlO2,反应的化学方程式为:Al2O3+2NaOH=NaAlO2+H2O。
(4)向“过滤”得到的滤液中通入过量CO2,可以将AlO2-转化为Al(OH)3,反应的离子方程式为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,OH-+CO2=HCO3-。
(5)过滤”得到的滤渣中含大量的Fe2O3,Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,设有xmolFe3O4和ymolFeS2完全参加反应,根据电子得失守恒:2x×(3-8/3)=2y×5+y×(8/3-2),解得x/y=16,所以理论上完全反应消耗的n(FeS2):n(Fe2O3)=1:16。


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】(1)分别写出下列物质的电子式:
N2______________ NaOH______ H2O2_________
(2)写出下列反应的化学方程式:
硅单质与氢氧化钠溶液的反应:_________。
二氧化氮与水反应:___________。
铜和浓硫酸加热反应:___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在一个密闭容器中进行的反应C(s)+H2O(g) ![]() CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
①增加C的量; ②增加CO的量;
③将容器的体积缩小一半; ④保持体积不变,充入N2以增大压强;
⑤升高反应体系的温度; ⑥保持压强不变,充入N2以增大体积。
A. ②③ B. ①④ C. ①⑥ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
M2+(g)+CO32-(g) ![]() M2+(g)+O2(g)+CO2(g)
M2+(g)+O2(g)+CO2(g)
![]()
![]()
![]()
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是
A. ΔH1(MgCO3)>ΔH1(CaCO3)>0
B. ΔH2(MgCO3)=ΔH2(CaCO3)>0
C. ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D. 对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g)2SO3(g) △H<0的影响如图所示,下列说法正确的是( )
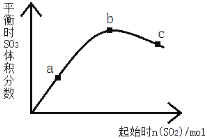
A. 反应b、c点均为平衡点,a点未达平衡且向正反应方向进行
B. a、b、c三点中,a点时SO2的转化率最高
C. 上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高
D. a、b、c三点的平衡常数Kb>Kc>Ka
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3g该有机物完全燃烧,生成0.1mol CO2和2.7g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1∶2∶3;
④用红外光谱仪处理该化合物,得到如图三所示图谱。
试回答下列问题:

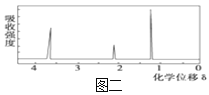
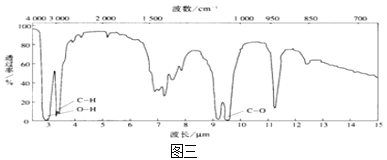
(1)有机物A的相对分子质量是___________;
(2)有机物A的实验式是___________;
(3)推测有机物A的结构简式为___________,A中含官能团的名称是_________;
(4)质量分数为11.6%的某饱和一元醛水溶液5 g,跟足量新制的Cu(OH)2悬浊液反应,生成Cu2O1.44 g。通过计算推导出该有机物的分子式并写出其结构简式_______、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过。电池充、放电的化学方程式为2Na2S2+NaBr3![]() Na2S4+3NaBr。当闭合K时,X极附近溶液先变红色。下列说法正确的是( )
Na2S4+3NaBr。当闭合K时,X极附近溶液先变红色。下列说法正确的是( )
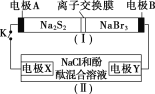
A.装置(Ⅰ)中Na+从右到左通过离子交换膜
B.电极A的电极反应式为NaBr3+2Na++2e-=3NaBr
C.电极X的电极反应式为2Cl--2e-=Cl2↑
D.每有0.1molNa+通过离子交换膜,电极X上就析出标准状况下的气体1.12L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中两种物质作用时,反应条件或反应物用量改变,对生成物没有影响的是( )
A.Na与O2B.Na2O2与CO2C.NaOH与CO2D.Cu与HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com